
某化学兴趣小组在老师指导下,进行了“H
2O
2生成O
2的快慢与什么因素有关”的实验.请你帮助回答下列问题.(实验均在20℃室温下进行)
(1)“用过氧化氢和二氧化锰制氧气”的反应方程式为:
.该操作过程中合理的排列顺序是:检验装置的气密性→将水槽中待收集气体的小试管注满水→
③
③
→
①
①
→
②
②
(选填序号).①待有连续稳定气泡再排水集气 ②旋紧连有导管的单孔胶塞
③向大试管内倒入适量过氧化氢再加入少许MnO
2粉末用试管进行排水法集气时,出现如图所示的3种操作,其中合理的是
C
C
.
若要证明MnO
2是该反应的催化剂,还需要增加实验来验证MnO
2在反应前后的化学性质和
质量
质量
是否改变.
(2)假设H
2O
2生成O
2的快慢与催化剂种类有关.在两瓶等体积6%的H
2O
2溶液中分别加入相同质量MnO
2和红砖粉,测量各生成一瓶(相同体积)O
2所需要的时间.记录数据如下:
| 实验编号 |
1 |
2 |
| 反应物 |
6% H2O2 |
6% H2O2 |
| 催化剂 |
1g红砖粉 |
1g MnO2 |
| 时间(s) |
152 |
35 |
由此得出的结论是
在相同条件下,H2O2生成O2的快慢与催化剂种类有关
在相同条件下,H2O2生成O2的快慢与催化剂种类有关
.
(3)假设H
2O
2生成O
2的快慢与不同质量分数的H
2O
2溶液有关.
在不同质量分数的H
2O
2溶液进行实验.记录数据如下:
| 实验编号 |
1 |
2 |
3 |
| H2O2溶液的溶质质量分数 |
5% |
10% |
20% |
| MnO2粉末用量(g) |
0.2 |
| 收集到500mL气体时所用时间(s) |
205 |
80 |
9 |
| 反应后溶液的温度(℃) |
39 |
56 |
67 |
从实验中得知该反应是个
放热
放热
反应(填“放热”或“吸热”),反应随H
2O
2溶液的质量分数的增加反应后液体温度逐渐
升高
升高
(填“升高”或“降低”).H
2O
2溶液的质量分数是怎样影响反应快慢?
在相同条件下,过氧化氢溶液中溶质的质量分数越大,反应速率越快
在相同条件下,过氧化氢溶液中溶质的质量分数越大,反应速率越快
.
(4)还有哪些因素可能影响该反应快慢?
请说出你的一个猜想:
其他条件不变时,改变此反应的温度,可影响此反应的速率
其他条件不变时,改变此反应的温度,可影响此反应的速率
.

 “化学反应条件的控制是实验灵魂”.某校化学兴趣小组在老师指导下,进行了“影响过氧化氢溶液分解因素”的实验.请你帮助回答下列问题.
“化学反应条件的控制是实验灵魂”.某校化学兴趣小组在老师指导下,进行了“影响过氧化氢溶液分解因素”的实验.请你帮助回答下列问题.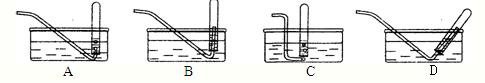
 某化学兴趣小组在老师指导下,进行了“H2O2生成O2的快慢与什么因素有关”的实验.请你帮助回答下列问题.(实验均在20℃室温下进行)
某化学兴趣小组在老师指导下,进行了“H2O2生成O2的快慢与什么因素有关”的实验.请你帮助回答下列问题.(实验均在20℃室温下进行)

