
题目列表(包括答案和解析)
 某化学兴趣小组为探究铜跟浓硫酸的反应,如图所示装置进行有关实验.
某化学兴趣小组为探究铜跟浓硫酸的反应,如图所示装置进行有关实验.
| ||
| ||
(1)化学兴趣小组所制得的气体X中混有的主要杂质气体可能是_________________(填分子式)。产生这种结果的主要原因是(用离子方程式表示)_________________。
(2)为了检验主要杂质气体的成分,化学兴趣小组的同学设计了如下实验,对气体X取样进行认真探究。
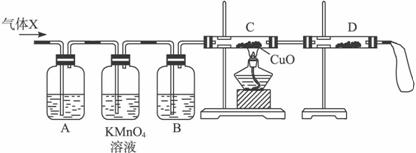
①组装好仪器后,盛放药品前,必要的一个操作是__________________________________。
②A中加入的试剂可能是____________,作用是__________________________________。
B中加入的试剂可能是____________,作用是____________________________________。
③证实气体X中混有较多杂质气体,应观察到C中的实验现象是____________________,D中最好选择的试剂是_________________。
(3)假定气体在吸收过程中吸收完全,对上述装置略加改进,可以粗略测定气体X中SO2的体积分数。改进时可选用的下列仪器为_________________(填代号)。
a.导管 b.水槽 c.广口瓶 d.容量瓶 e.量筒 f.单孔塞 g.双孔塞
某化学兴趣小组为探究铜与浓硫酸的反应,用下图所示装置进行有关实验。请回答下列问题。
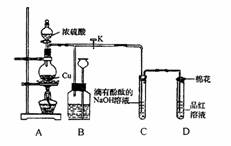
(1)写出装置A中玻璃仪器的名称
(2)装置B的作用是贮存多余的气体,B中广口瓶内应盛放的液体是(填序号)
①水 ②酸性高锰酸钾溶液
③碳酸钠溶液 ④饱和亚硫酸氢钠溶液
(3)装置C和D中产生的现象相同,但原因却不同。C中是由于SO2与NaOH发生反应,请写出有关反应的离子方程式 而D中是因为SO2具有 性,。
(4)实验完毕,待A中烧瓶中液体冷却后,过滤,向滤液中加入少量的蒸馏水稀释,溶液呈蓝色,为了证明蓝色只与铜离子有关,而与其它离子无关,某同学设计了下列实验,其中对实验目的没有意义的是(填序号)
①观察稀硫酸溶液呈无色
②观察硫酸铜粉末呈白色
③稀破硫酸铜溶液,溶液蓝色变浅
④往硫酸铜溶液中加入足量NaOH溶液,生成蓝色沉淀,过滤,滤液呈无色
⑤往硫酸铜溶液中加入足量Ba(NO3)2溶液,生成白色沉淀,过滤,滤液仍呈蓝色
(5)若实验中用7.2g铜片和12.5mL 18mol?L―1的浓硫酸在加热条件下充分反应,最终铜片仍有剩余。某同学认为溶液中一定也有硫酸剩余,其理由是 。
(1)化学兴趣小组所制得的气体X中混有的主要杂质气体可能是__________(填分子式)。产生这种结果的主要原因足(用离子方程式表示) ______________________。
(2)为了检验主要杂质气体的成分,化学兴趣小组的同学没计了如下实验,对气体X取样进行认真探究。
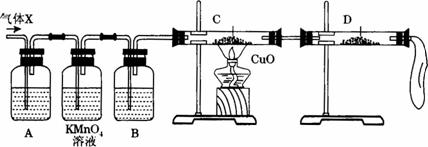
①组装好仪器后,盛放药品前,必要的一个操作是___________________________________。
②A中加入的试剂可能是__________________,作用是____________________________。
B中加入的试剂可能是____________________,作用是____________________________。
③证实气体X中混有较多杂质气体,应观察到C中的实验现象是______________,D中最好选择的试剂是______________________。
(3)假定气体在吸收过程中吸收完全,对上述装置略加改进,可以粗略测定气体X中SO2的体积分数。改进时可选用的下列仪器为__________________(填代号)。
a.导管 b.水槽 c.广口瓶 d.容量瓶 e.量筒 f.单孔塞 g.双孔塞
某化学兴趣小组需制备22.4 LSO2气体(标准状况),他们依据化学方程式Zn+2H2SO4(浓)![]() ZnSO4+SO2↑+2H2O计算后,取65.0 g锌粒与98%的浓硫酸(ρ=1.84 g/cm3)110mL充分反应,待锌粒全部溶解后,收集所得气体X。经测定其中含有气体杂质。
ZnSO4+SO2↑+2H2O计算后,取65.0 g锌粒与98%的浓硫酸(ρ=1.84 g/cm3)110mL充分反应,待锌粒全部溶解后,收集所得气体X。经测定其中含有气体杂质。
(1)化学兴趣小组所制得的气体X中混有的主要杂质气体可能是 (填分子式)。产生这种结果的主要原因是(用离子方程式表示) 。
(2)为了检验主要杂质气体的成分,化学兴趣小组的同学设计了如下实验,对气体(X)取样进行认真探究。
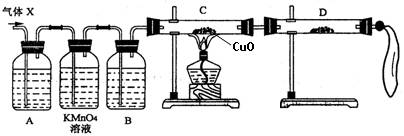
①组装好仪器后,盛放药品前,必要的一个操作是 。
②A中加入的试剂可能是 ,作用是 。
B中加入的试剂可能是 ,作用是 。
③证实气体X中混有较多杂质气体,应观察到C中的实验现象是 ,D中最好选择的试剂是 。
(3)假定气体在吸收过程吸收完全,对上述装置略加改进,可以粗略测定X气体中SO2的体积分数。改进时可选用的下列仪器为 (填代号)。
a.导管 b.水槽 c.广口瓶 d.容量瓶 e.量筒 f.单孔塞 g.双孔塞
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com