
题目列表(包括答案和解析)

请回答下列问题:
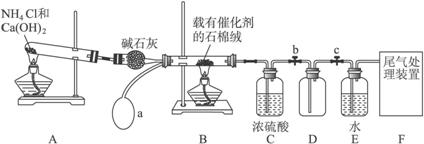
(1)写出装置A中主要反应的化学方程式______________________________________。
(2)已知1 mol NO2与液态水反应生成HNO3溶液和NO气体放出热量46 kJ,写出该反应的热化学方程式_______________________________________________________________。
该反应是一个可逆反应,欲提高NO2的转化率,可采取的措施是___________________。
A.降低温度 B.升高温度
C.减小压强 D.增大压强
(3)实验结束后,关闭止水夹b、c,将装置D浸入冰水中,现象是___________________。
(4)装置C中浓H2SO4的作用是_____________________________________________。
(5)请你帮助该化学小组设计实验室制取NH3的另一方案____________________________。
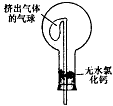
(6)干燥管中的碱石灰用于干燥NH3,某同学思考是否可用无水氯化钙代替碱石灰,并设计下图所示装置(仪器固定装置省略未画)进行验证。实验步骤如下:

①用烧瓶收集满干燥的氨气,立即塞上如图所示的橡胶塞。
②正立烧瓶,使无水氯化钙固体滑入烧瓶底部,摇动,可观察到的现象是__________________,由此,该同学得出结论:不能用CaCl2代替碱石灰。

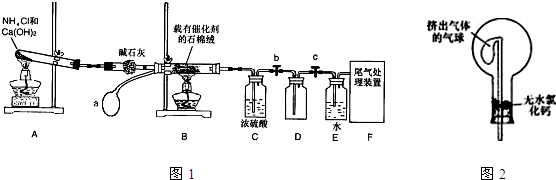
某化学小组模拟工业生产制取HNO3,设计下图所示装置,其中a为一个可持续鼓入空气的橡皮球。
请回答下列问题:
(1)写出装置A中主要反应的化学方程式 。
(2)已知1molNO2与液态水反应生成HNO3溶液和NO气体放出热量46kJ,写出该反应的热化学方程式 。
该反应是一个可逆反应,欲要提高NO2的转化率,可采取的措施是 。
A.降低温度 B.升高温度 C.减小压强 D.增大压强
(3)实验结束后,关闭止水夹b、c,将装置D,浸入冰水中,现象是
。
(4)装置C中浓H2SO4的作用是 。
(5)请你帮助该化学小组设计实验室制取NH3的另一方案
。
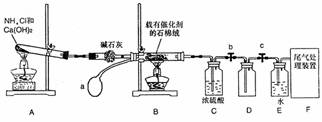
(6)干燥管中的碱石灰用于干燥NH3,某同学思考是否可用无水氯化钙代替碱石灰,并设计右图所示装置(仪器固定装置省略未画)进行验证。实验步骤如下:
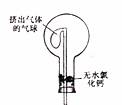 ①用烧瓶收集满干燥的氨气,立即塞上如图的示的橡胶塞。
①用烧瓶收集满干燥的氨气,立即塞上如图的示的橡胶塞。
②正立烧瓶,使无水氯化钙固体滑入烧瓶底部,摇动,可观察到
的现象是 ,
由此,该同学得出结论:不能用CaCl2代替石灰。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com