
题目列表(包括答案和解析)

 2CO2的平衡常数为K1;反应4Fe+3O2
2CO2的平衡常数为K1;反应4Fe+3O2 2Fe2O3的平衡常数K2,则反应
2Fe2O3的平衡常数K2,则反应 2Fe+3CO2的平衡常数K与K1、K2的关系式___________。
2Fe+3CO2的平衡常数K与K1、K2的关系式___________。 2Fe+3CO ② Fe2O3+3CO
2Fe+3CO ② Fe2O3+3CO 2Fe+3CO2
2Fe+3CO2  的取值范围是_________________。
的取值范围是_________________。 2AlCl3(g)+3CO(g) △H>0,欲提高金属铝的氯化效果,不可采取的措施是______(填序号):
2AlCl3(g)+3CO(g) △H>0,欲提高金属铝的氯化效果,不可采取的措施是______(填序号): | O | 2- 4 |
| c(H+).c(Cl-).c(HClO) |
| C(Cl2) |
| 0.03×0.03×0.03 |
| 0.06 |
| c(H+).c(Cl-).c(HClO) |
| C(Cl2) |
| 0.03×0.03×0.03 |
| 0.06 |
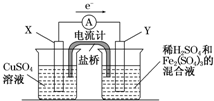 (2010?宝鸡一模)(2011?长春质检)金属铜不溶于稀硫酸,可溶于铁盐溶液生成铜盐与亚铁盐.现将一定量的铜片加入到100mL稀硫酸和硫酸铁的混合液中,铜片完全溶解(不考虑盐的水解及溶液体积的变化)
(2010?宝鸡一模)(2011?长春质检)金属铜不溶于稀硫酸,可溶于铁盐溶液生成铜盐与亚铁盐.现将一定量的铜片加入到100mL稀硫酸和硫酸铁的混合液中,铜片完全溶解(不考虑盐的水解及溶液体积的变化)2- 4 |
| 正、负极判断 | 电极材料 | 电极反应式 | |
| X极 | 负 负 |
铜 铜 |
Cu-2e-═Cu2+ Cu-2e-═Cu2+ |
| Y极 | 正 正 |
碳 碳 |
2Fe3++2e-═2Fe2+ 2Fe3++2e-═2Fe2+ |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com