(2009?静安区二模)白铁即镀锌铁皮,某学习小组的三位同学为了测定锌镀层的厚度,提出了各自的设计方案.
Ⅰ.甲同学的方案是,先用盐酸将镀锌铁皮表面的锌反应掉,通过差量算出锌的质量,然后再由查得的锌密度算出锌层的体积,最后由体积除以镀锌铁皮面积算得锌层厚度.
(1)配制1mol/L的盐酸100mL,需取用36.5%(ρ=1.181g/cm
3)的盐酸
8.5
8.5
mL;配制过程中要用到的玻璃仪器除量筒、烧杯、玻璃棒外,还有
100mL容量瓶、胶头滴管
100mL容量瓶、胶头滴管
.
(2)将相同大小相同厚度的普通锌片和镀锌铁皮放入两只试管,各加入同量1mol/L的盐酸,观察镀锌铁皮比普通锌片与盐酸反应速率更快,产生此现象的原因是
镀锌铁皮发生了原电池反应
镀锌铁皮发生了原电池反应
;在翻动横放在烧杯中镀锌铁皮时,发现溶液上方的锌层变薄的速率比下方的锌层快得多,其原因可能是
下方的气泡阻止了酸液与锌层的接触
下方的气泡阻止了酸液与锌层的接触
.
(3)判断镀锌铁皮表面锌恰好反应的现象是
产生气泡的速率明显下降
产生气泡的速率明显下降
.
Ⅱ.乙同学的意见及方案.
(1)意见:因为难以避免铁也会反应,所以甲同学测出锌的厚度会
偏大
偏大
(选填偏大或偏小).
(2)方案:通过查阅资料,知道Zn(OH)
2既可以和酸反应又可以和碱反应,于是设计了如下方案:

步骤③的操作是
过滤、洗涤
过滤、洗涤
;若使用的镀锌铁片的质量为28.156g,最后称得灼烧后固体的质量为40.000g,镀锌铁片的长5.10cm,宽5.00cm,锌的密度ρ=7.14g/cm
3,则锌镀层的厚度为
4.30×10-4
4.30×10-4
cm.
Ⅲ.丙同学查得Fe(OH)
2、Zn(OH)
2开始沉淀的pH分别为6.5和5.6,认为也可用容量法(即滴定法)检测且准确度更高.该方法的要点是:准确称取m g白铁,加入过量c mol/L的盐酸bml,再用标准NaOH溶液滴定过量的盐酸,为了防止生成沉淀,应选用的指示剂是
c
c
(选填序号).
a.酚酞 b.石蕊 c.甲基橙.

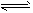 Fe(SCN)3,加入KCl固体,颜色不应该有变化,但现象却是变浅了,请你分析变浅的可能原因是_____________________。
Fe(SCN)3,加入KCl固体,颜色不应该有变化,但现象却是变浅了,请你分析变浅的可能原因是_____________________。 