
题目列表(包括答案和解析)
元素周期表中的六种元素①②③④⑤⑥位置如下图所示:
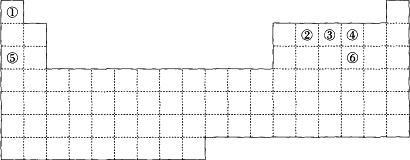
回答下列问题:
(1)由②④⑤三种元素组成的无机物(相对分子质量106),其水溶液呈碱性,用离子方程式表示其原因________.
(2)只含①③④三种元素的一种常见离子化合物中,元素③的化合价分别处于最高价和最低价,则其水溶液中离子浓度的由大到小顺序为________.
(3)元素③的氢化物与元素④单质在一定条件下发生置换反应,在该反应中氧化剂与还原剂的物质的量之比为________.
(4)用惰性电极电解元素⑥的最高价氧化物对应水化物的稀溶液,阳极的电极反应式为________.
(5)由④⑤形成的原子个数1∶1的化合物的电子式为________.
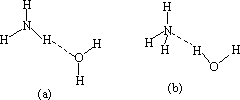
(6)NH3·H2O的电离方程式为NH3·H2O![]() NH4++OH-,试判断NH3溶于水后,形成的NH3·H2O的合理结构是:________
NH4++OH-,试判断NH3溶于水后,形成的NH3·H2O的合理结构是:________
(7)利用稀有气体化合物,人们实现了许多制备实验的突破,如用XeO3在碱性条件下与NaBrO3反应生成NaBrO4,同时释放出Xe,写出上述反应的离子方程式:________
氮元素的化合价较多,负价态氮和正价态氮之间发生氧化还原反应时会有氮气生成.下面介绍的是甲、乙两位同学设计的两种制备少量氮气的不同实验方案的示意图(如图所示,箭头表示气体流向).

试回答下列问题:
(1)甲、乙两位同学的实验方案是否能制氮气?甲________,乙________(填“能”或“不能”).
(2)若不能制得氮气,请具体说明原因,并指出纠正的办法(如均能制得N2,此小题不作答).
(3)甲方案中的碱石灰是否可换成浓H2SO4?说明理由.
(4)甲、乙两位同学按正确操作制得氮气,相同条件下,用密度法测出的氮气式量为M(精确到0.001).若进行比较,有M甲________M乙(填“大于”、“小于”或“等于”).
氮元素的化合价态较多,负价态氮与正价态氮之间发生氧化还原反应时会有氮气生成.下面介绍的甲、乙两位学生设计的两种制备少量氮气的不同实验方案的示意框图(箭头表示气体流向).

试回答下列问题:
(1)甲、乙两位学生的实验方案是否能制得氮气?
甲________,乙________.(填“能”或“不能”)
(2)若不能制得氮气,请具体说明原因,并指出纠正的办法.(如两种方案都能制得氮气,此小题不要回答)
(3)甲方案中所用的碱石灰是否可换成浓硫酸?请说明理由.
(4)甲、乙两位同学若按正确操作制得氮气,在相同条件下,用密度法测出的氮气相对分子质量为Mr(精确到0.001),若进行比较,有Mr(甲)________Mr(乙).(填“大于”、“等于”或“小于”)
Ⅰ.反应物与生成物有:浓H2SO4、K2S、K2SO4、SO2、H2O和一种未知物质X.
(1)已知K2S在反应中失去电子,则该反应的氧化剂是________.
(2)已知0.5 mol K2S在反应中失去1 mol电子生成X,则X的化学式为________.
(3)将氧化剂和还原剂及其配平后系数填入下列空格中,并标出电子转移的方向和数目:
(4)若反应中浓H2SO4过量,则________产物中无X生成,请完成此化学反应方程式:________.
Ⅱ.短周期元素X、Y、Z的原子序数依次增大,X和Y同主族,Y和Z同周期,Y与Z能形成离子个数比为1∶1的离子化合物A,X与Z能形成原子个数比为1∶1的共价化合物B,它们之间能实现如图所示转化(部分产物已略去):
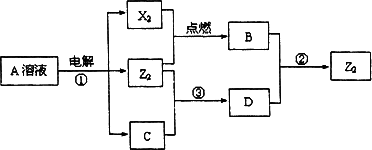
(1)Y在周期表的位置是________;
(2)反应①的化学方程式是________.
(3)D溶液呈碱性的原因是(用离子方程式表示)________.
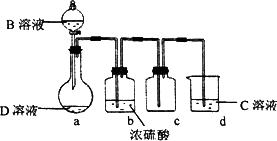
D是很多漂白剂中含有的有效成分,这些产品不能与洁厕灵(含有有机酸和无机酸)一起使用,其原因就是在常温时能发生与反应②相似的反应.某校的学生在实验室利用反应②的原理来制备纯净、干燥的Z2,仪器装置如图所示(夹持固定装置的仪器已略去).
(4)写出反应②的离子方程式________.
(5)上述实验装置不够完善,改进方法是________.
下表是元素周期表的一部分.
(1)表中元素⑩的氢化物的化学式为 ,此氢化物的还原性比元素⑨的氢化物的还原性 (填强或弱)
(2)某元素原子的核外电子层中L层电子数比K层电子数多3,则该元素的元素符号是 ,其单质的电子式为 .
(3)已知某些不同族元素的性质也有一定的相似性,如元素③与元素⑧的氢氧化物有相似的性质。写出元素③的氢氧化物与NaOH溶液反应的化学方程式:
;
又如表中与元素⑦的性质相似的不同族元素是 (填元素符号)
(4)元素⑤的氢化物是最重要的氮肥,是产量最大的化工产品之一。课本里介绍的合成氨技术叫哈伯法,是德国人哈伯在1905年发明的,其合成原理为:N2(g)+3H2(g)![]() 2NH3(g) △H= -92.4kJ/mol,他因此获得了1918年诺贝尔化学奖。试回答下列问题:
2NH3(g) △H= -92.4kJ/mol,他因此获得了1918年诺贝尔化学奖。试回答下列问题:
①合成氨工业中采取的下列措施可用勒夏特列原理解释的是 (填序号)
A.采用较高压强(20Mpa~50Mpa)
B.采用500℃的高温
C.用铁触媒作催化剂
D.将生成的氨液化并及时从体系中分离出来,N2和H2循环到合成塔中并补充N2和H2
②上图是实验室模拟工业法合成氨的简易装置。简述检验有氨气生成的方法 。
③在298K时,将10 mol N2和30 mol H2放入合成塔中,为何放出的热量小于924kJ?
。
④1998年希腊亚里斯多德大学的Marmellos和Stoukides发明一种合成氨的新方法。在常压下,将H2与用He稀释的N2分别通入一加热到570℃的,以锶-铈-钇-钙钛矿多孔陶瓷(SCY)为固体电解质的电解池中转化为氨气(SCY陶瓷能传递H+),H2转化率达到78%。其实验装置如图所示。阴极的电极反应式 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com