
题目列表(包括答案和解析)
现代社会中铜在不同领域有广泛的应用。某铜矿石含氧化铜、氧化亚铜、三氧化二铁和脉石(SiO2),现采用酸浸法从矿石中提取铜,其工艺流程图如下。其中铜的萃取(铜从水层进入有机层的过程)和反萃取(铜从有机层进入水层的过程)是现代湿法炼铜的重要工艺手段。
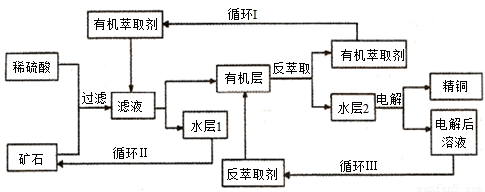
已知:反萃取后的水层2是硫酸铜溶液。回答下列问题:
(1)矿石用稀硫酸处理过程中发生多步反应,除了发生Cu2O+2H+=Cu2++Cu+H2O和Fe2O3+6H+=2Fe3++3H2O反应外,其它反应的离子方程式为____________________________________________。
(2)检验滤液中是否含有Fe3+的方法是____________________________________________________。
(3)“循环I”经多次循环后的水层1不能继续循环使用,但可分离出一种重要的硫酸盐,若水层1暴露在空气中一段时间后,可以得到另一种重要的硫酸盐,写出水层l暴露在空气中发生反应的离子方程式________ _____________。
(4)写出电解过程中阳极(惰性电极)发生反应的电极反应式 __________________。
(5)“循环Ⅲ”中反萃取剂的主要成分的化学式是________________。
(6) 黄铜矿(主要成分CuFeS2)是提取铜的主要原料,可采用火法溶炼工艺生产铜,该工艺的中间过程会发生反应:Cu2S+2Cu2O=6Cu+SO2↑。该反应中,_______ (填化学式)作还原剂,每生成1mol Cu,反应中转移电子的物质的量为____________。
铜是生物必需的微量元素,也是人类最早使用的金属之一。铜的生产和使用对国计民生各个方面都产生了深远的影响。
(1)写出铜与稀硝酸反应的化学方程式____________________________________________________。
(2)为了保护环境和节约资源,通常先用H2O2和稀硫酸的混合溶液溶出废旧印刷电路板中的铜,最终实现铜的回收利用。写出溶出铜的离子方程式__________________________________________________。
(3)工业上以黄铜矿为原料,采用火法溶炼工艺生产铜。该工艺的中间过程会发生反应:2Cu2O+ Cu2S 6Cu+SO2,该反应的氧化剂是___________________;当生成19.2gCu时,反应中转移的电子为____________mol。
6Cu+SO2,该反应的氧化剂是___________________;当生成19.2gCu时,反应中转移的电子为____________mol。
(4)铜在潮湿的空气中能发生吸氧腐蚀而生锈,铜诱的主要成分为Cu2(OH)2CO3(碱式碳酸铜)。试写出上述过程中负极的电极反应式__________________________。
(5)研究性学习小组用“间接碘量法”测定某试样中CuSO4·5H2O(不含能与I-反应的氧化性杂质)的含量。取ag试样配成100mL溶液,每次取25.00mL,滴加KI溶液后有白色碘化物沉淀生成。写出该反应的离子方程式________________________________________。继续滴加KI溶液至沉淀不再产生,溶液中的I2用硫代硫酸钠标准溶液滴定,发生反应的化学方程式为:I2+2Na2S2O3=2NaI+Na2S4O6,平均消耗cmol/L的Na2S2O3 溶液VmL。则试样中CuSO4·5H2O的质量分数为____________。
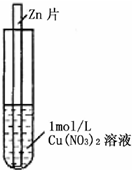 (2011?上饶二模)如图,将一锌片放入1mol?L-1蓝色Cu(NO3)2溶液中,观察到下列实验现象:①反应初期锌片上有大量气泡冒出,同时液面的上一层Cu(NO3)2溶液开始呈现绿色,并且逐渐向液面下的深处扩散,试管底部有红色固体出现.②与锌片接触的溶液温度明显升高,反应越来越剧烈,并在红色固体上方开始出现一层蓝色沉淀,并逐渐增多.③反应后期溶液逐渐变为无色,试管底部又有部分白色沉淀物.
(2011?上饶二模)如图,将一锌片放入1mol?L-1蓝色Cu(NO3)2溶液中,观察到下列实验现象:①反应初期锌片上有大量气泡冒出,同时液面的上一层Cu(NO3)2溶液开始呈现绿色,并且逐渐向液面下的深处扩散,试管底部有红色固体出现.②与锌片接触的溶液温度明显升高,反应越来越剧烈,并在红色固体上方开始出现一层蓝色沉淀,并逐渐增多.③反应后期溶液逐渐变为无色,试管底部又有部分白色沉淀物.| 催化剂 |
| △ |
| 实验序号 | 温度℃ | 初始CCl4浓度(mol?L-1) | 初始H2浓度(mol?L-1) | CCl4的转化率 |
| 1 | 110 | 0.8 | 1.2 | a |
| 2 | 110 | 1 | 1 | 50% |
| 3 | 120 | 1 | 2 | x |
| 4 | 120 | 1 | 4 |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com