(2013?达州模拟)有A、B、C、D、E五种短周期元素,其中A元素和B元素的原子都有一个未成对电子,A
+比B
-少一个电子层,B原子得一个电子后3p轨道全充满;C原子的p轨道中有3个未成对电子,其气态氢化物在水中的溶解度在同族元素所形成的氢化物中最大;D的最高化合价与最低化合价代数和为4;E元素的基态原子核外有六种运动状态的电子.请回答下列问题:
(1)A元素的简单离子基态时的电子排布式为
1s22s22p6
1s22s22p6
R是由C元素与氢元素两种元素形成的18电子分子,R的电子式为
(2)CB
3分子的空间构型是
三角锥型
三角锥型
,其中心原子的杂化类型是
sp3
sp3
(3)由D、E、C三元素可形成共价化合物(DEC)
2(分子中各原子均达8电子稳定结构),每个分子中含
5
5
个δ键.
(4)E的一种低价氧化物与充入二氧化碳的空气和熔融碳酸钾可构成燃料电池.则该燃料电池的负极反应为
CO+CO32--2e-=2CO2
CO+CO32--2e-=2CO2
正极反应为
O2+2CO2+4e-=2CO32-
O2+2CO2+4e-=2CO32-
(5)1.2gE的单质在标准状况下的1.68L氧气中燃烧,至反应物耗尽,放出X KJ热量.则1molE与O2反应生成E的低价氧化物时的热化学方程式为
C(s)+
O
2(g)=CO(g)△H=-(20X-Y)kJ/mol
C(s)+
O
2(g)=CO(g)△H=-(20X-Y)kJ/mol
(已知:E的燃烧热为Y KJ/mol)

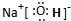
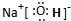




 有A、B、C、D、E五种短周期元素,其原子序数依次增大.A原子的电子层数与它的核外电子总数相同,B原子核外最外层电子数是次外层电子数的2倍,C元素的原子基态时2p能级是2s能级上的电子数的2倍,D是该周期中原子半径最大的主族元素,E原子的第一至第四电离能(kJ?mol-1)分别为:578、1817、2745、11575.请回答下列问题:
有A、B、C、D、E五种短周期元素,其原子序数依次增大.A原子的电子层数与它的核外电子总数相同,B原子核外最外层电子数是次外层电子数的2倍,C元素的原子基态时2p能级是2s能级上的电子数的2倍,D是该周期中原子半径最大的主族元素,E原子的第一至第四电离能(kJ?mol-1)分别为:578、1817、2745、11575.请回答下列问题: