
题目列表(包括答案和解析)
10、阅读材料:设一元二次方程ax2+bx+c=0(a≠0)的两根为x1,x2,则两根与方程系数之间有如下关系:x1+x2=-![]() ,x1·x2=
,x1·x2=![]() .根据该材料填空:已知x1,x2是方程x2+6x++3=0的两实数根,则
.根据该材料填空:已知x1,x2是方程x2+6x++3=0的两实数根,则![]() +
+![]() 的值为(▲)
的值为(▲)
A.4 B.6 C.8 D.10
| ||
| mFe/m 0 | 7/3 | 14/5 | 7/2 |
| 固体成份 | Fe2O3 | Fe2O3、Fe0 | |
| 转化率(α) | 0 | 100% |
| ||
| ||
| 第一次 | 第二次 | 第三次 | |
| 加入稀硫酸的质量(g) | 50 | 50 | 50 |
| 生成氢气的质量(g) | 0.4 | m | 0.2 |
| 实验次序 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
| H2O2溶液溶质质量分数 | 1% | 3% | 5% | 10% | 15% | 20% | 25% | 30% |
| MnO2粉末用量(克) | m | m | m | m | 0.6 | 0.6 | 0.6 | 0.6 |
| 收集到500ml气体所需时间(秒) | 660 | 220 | 205 | 80 | 25 | 9 | 4 | 3 |
| 反应后液体温度(℃) | 24 | 34 | 39 | 56 | 65 | 67 | 69 | 70 |
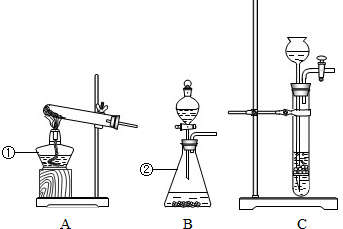
| 实验装置 | 实验步骤 | 分析 |
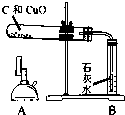 |
①检验装置气密性 | |
| ②把木炭和氧化铜的混合物放入试管,如左图所示连接实验装置 | 装置中存在的问题是 (1)B试管处不应该有橡皮塞 (1)B试管处不应该有橡皮塞 ; | |
| ③改进装置后,点燃酒精喷灯开始实验 | 装置B的作用是 (2)检验产物是否有二氧化碳 (2)检验产物是否有二氧化碳 ; | |
| ④反应结束时,先将导管从装置B中撤出,再停止加热 | 目的是 (3)防止液体倒流引起试管炸裂 (3)防止液体倒流引起试管炸裂 ; | |
| ⑤待试管冷却后将剩余固体M倒入烧杯,加入足量稀硫酸,过滤 | 得到蓝色滤液 滤渣为红色和黑色固体混合物 |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com