
题目列表(包括答案和解析)
胃酸过多是常见的胃病.下面是甲、乙两种常见胃药的说明摘要.
甲:①白色结晶状粉末,受热可缓缓分解;②能溶于水,水溶液呈弱碱性;灼烧时火焰为黄色;③遇酸及酸性药物则产生二氧化碳;④患者服用过量,可能引起胃胀气,甚至有引起胃溃疡穿孔的危险.
乙:①与胃酸是中和作用缓慢而持久,可维持3~4小时;②凝胶本身覆盖于溃疡面上,具有保护作用;③可溶于稀酸或氢氧化钠溶液中.
(1)请你推测,甲中含有的主要化学成份是________(填化学式);乙中含有的主要化学成份是________(填化学式).
(2)试写出甲中含有的主要化学成份引起胃胀气反应的离子方程式:________.
(3)三硅酸镁Mg2Si3O8·nH2O也是常用胃药,被用来治疗胃溃疡,是因为该物质不溶于水,服用后中和胃酸作用持久.把三硅酸镁改写成氧化物形式为:________.
写出它中和胃酸(胃酸的主要成分是HCl)的化学方程式________.
(4)目前一种新型抗酸剂能迅速改善和缓解胃酸过多的症状,它主要由碳酸镁、氢氧化镁和氢氧化铝组成(说明:Mg(OH)2在高温下分解为MgO).现按如下步骤测定药剂中三种主要成分的配比:
①取药剂样品,研磨后,加入50 mL 3.6 mol·L-1盐酸,正好完全反应并收集得到标准状况下224 mL气体
②过滤,弃去其中不溶性物质(其余成分不参与反应)
③取②中滤液,加入足量的NaOH溶液后,过滤、洗涤、灼烧,所得固体2.4 g.
则该药剂中三种主要成分的物质的量之比为n(MgCO3)∶n(Mg(OH)2)∶n(Al(OH)3)=________.
| 族 周期 |
ⅠA | 0 | ||||||
| 1 | ① | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
| 2 | ② | ③ | ④ | |||||
| 3 | ⑤ | ⑥ | ⑦ | |||||


| ||
| ||
(08淄博市模拟)(18分)某学习兴趣小组探究废干电池(锌筒内填有炭粉、MnO2、NH4Cl等的糊状物)的回收利用,并用回收的物质进行如下实验。
I.(1)从废干电池中提取NH4Cl。
① 利用该糊状物提取NH4Cl前两步的操作为:a.溶解 b. 。
② 甲同学设想:将分离出的NH4Cl溶液蒸发、结晶、灼烧,就可以制得纯净的NH4Cl。请对甲同学的方案作出评价并说明理由:______________________________________
。
(2)制取氨气。
① 乙同学要制备并收集到纯净的氨气,下列各反应及操作中合理的是
a.将氯化铵固体加热分解 b.将浓氨水滴入氢氧化钠固体中
c.将氢氧化钠固体加入浓氨水中 d.将氯化铵浓溶液滴入氢氧化钠固体中

② 乙同学认为将集气瓶正放在桌上(如图所示),就可以收集到纯净的氨气。
你若认为可行,请说明其操作:_____________________________。
你若认为不可行,请说明其理由:___________________________。
Ⅱ.丙同学利用上面得到的氨气制取氨水并进行了如下探究实验:
(3)为探究NH3?H2O是否是弱电解质。
丙该同学设计方案如下:① 将1.12L(标况)NH3完全溶于水,配得溶液500mL;
② ;③分析数据,即
可得出结论。
请把最简单的实验步骤②,填写在上面的空格中。
 (4)探究氨水与盐酸的反应过程。
(4)探究氨水与盐酸的反应过程。
丙同学进行了如下实验:向25mL上述氨水中逐
滴滴加同浓度的盐酸,测定反应过程中溶液pH并绘
制其pH变化曲线(如图)。请回答:
①酸碱恰好完全中和时的pH点应是_________
(填A或B或D),此时溶液中c(NH3?H2O)+c(NH4+)=______mol?L-1,溶液中
各离子的浓度由大到小的顺序为 。
III.请参与探究
(5)请完成以下探究实验报告。
【探究课题】比较在25℃、0.1mol?L-1的NH3?H2O溶液和0.1mol?L-1的NH4Cl溶液中,NH3?H2O的电离程度与NH4+水解程度的相对大小。
【探究方案】2014年全运会在辽宁举办,其开幕式就是一场焰火盛宴。
(1)焰火利用了部分金属元素特征的________反应,该反应属于________(填“物理”或“化学”)变化。
(2)如图所示的五元环代表A、B、C、D、E五种化合物,圆圈交叉部分指两种化合物含有一种相同元素,五种化合物由五种短周期元素组成,每种化合物仅含两种元素。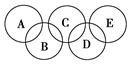
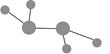
图中A是沼气的主要成分,B、E分子中所含电子数均为18,B不稳定,具有较强的氧化性,其稀溶液是医疗上广泛使用的消毒剂,E分子结构的球棍模型为 ,C与纯碱在高温下的反应是工业制玻璃的主要反应之一,D中所含两种元素的原子个数比为3∶4,电子总数之比为3∶2。根据以上信息回答下列问题:
,C与纯碱在高温下的反应是工业制玻璃的主要反应之一,D中所含两种元素的原子个数比为3∶4,电子总数之比为3∶2。根据以上信息回答下列问题:
①B的水溶液呈弱酸性,其主要的电离方程式可表示为________________,D的化学式是________。
②A、B、E中均含有的一种元素符号为________。
③C与纯碱反应的化学方程式为____________________________________。
④液态B与液态E反应可生成一种单质和一种常见液体,1 mol B参加反应放出热量Q kJ,其反应的热化学方程式为________________________。
 ,C与纯碱在高温下的反应是工业制玻璃的主要反应之一,D中所含两种元素的原子个数比为3∶4,电子总数之比为3∶2。根据以上信息回答下列问题:
,C与纯碱在高温下的反应是工业制玻璃的主要反应之一,D中所含两种元素的原子个数比为3∶4,电子总数之比为3∶2。根据以上信息回答下列问题:湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com