
题目列表(包括答案和解析)

| ||
| ||
| ||
| ||
A.在2 L0.15 mol/L K2SO4溶液中,含有K+和![]() 的总数为0.9 NA
的总数为0.9 NA
B.含有5.3 g Na2CO3的溶液中,有0.05 NA个![]() 离子
离子
C.常温常压下,NA个氢分子和NA个氦分子含的质子数不相同
D.当稀硝酸跟5.6 gFe反应完全时,电子转移一定是0.3 NA
I.甲醇是一种可再生燃料,它的沸点为64.7oC。有科学家提出:把含有过量CO2的空气吹入碳酸钾溶液中,然后再把CO2从溶液中提取出来,经化学反应后得到甲醇,其构想流程如下:
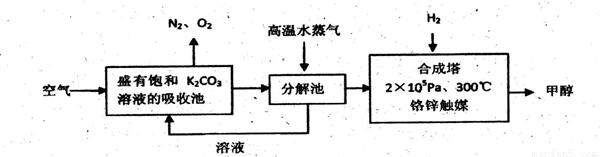
试回答下列问题:
(1)写出吸收池中主要反应的化学方程式 。
(2)在2×105pa、300℃合成塔中,若有440gCO2与H2恰好完全反应生成甲醇和水,放出495kJ的热量,试写出合成塔中发生反应的热化学方程式 。
(3)甲醇的一个重要作用是可以制燃料电池,常用KOH作电解质溶液,负极的电极反应式为:
。
Ⅱ.二氧化氯(C1O2)为一种黄绿色气体,是国际上公认的高效、广谱、快速、安全的杀菌消毒剂。
(1)工业上制备C1O2的反应原理常采用:2NaC1O3+4HC1=2C1O2↑+C12↑+2H2O+2NaC1。若反应中产生0.1mo1C1O2,则转移电子的物质的量为________mol。
(2)目前已开发出用电解法制取C1O2的新工艺。
①下图示意用石墨做电极,在一定条件下 电解饱和食盐水制取C1O2。写出阳极产生C1O2的电极反应式:____。
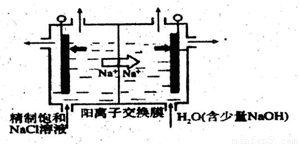
②电解一段时间.当阴极产生的气体体积为112mL(标准状况)时,停止电解。
通过阳离子交换膜的阳离子的物质的量为 mol;用平衡移动原理解释阴极区pH增大的原因 。
(3)C1O2对污水中Fe2+、Mn2+、S2-和CN-等有明显的去除效果。某工厂污水中含CN-,现用C1O2将CN-氧化,产物中有两种为气体,其离子反应方程式为 。
用NA表示阿伏加德罗常数,下列的叙述正确的是( )
A.在2 L 0.15 mol·L-1 K2SO4溶液中,含有K+和![]() 的总数为0.9NA
的总数为0.9NA
B.在标准状况下46 g NO2含有NA个分子
C.a g某气体含有分子数为b,则c g该气体在标准状况下的体积是22.4bc/aNA L
D.当稀硝酸跟5.6 g Fe反应完全时,电子转移一定是0.3NA
Cr2O![]() +H2O
+H2O![]() 2HCrO
2HCrO![]() HCrO
HCrO![]()
![]() H++CrO
H++CrO![]()
已知Na2Cr2O7和Na2SO4的溶解度曲线如下图所示。为把含有少量Na2SO4的Na2Cr2O7晶体提纯,可采取以下方法:①趁热过滤;②用降温法结晶分离出Na2Cr2O7;③加适量水将含有少量杂质的Na2Cr2O7溶解成饱和溶液;④加热至100 ℃以上蒸发收缩;⑤加稀H2SO4酸化。
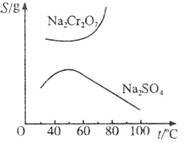
(1)操作步骤的正确顺序是(填序号)____________________________。
(2)用稀H2SO4酸化的目的是__________________________________________。
(3)趁热过滤的目的是__________________________________________。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com