
题目列表(包括答案和解析)
| 酸 | 电离方程式 | 电离平衡常数K |
| CH3COOH | CH3COOH?CH3COO-+H+ | 1.76×10-5 |
| HClO | HClO?ClO-+H+ | 2.95×10-8 |
| H2S | H2S?H++HS- HS-?H++S2- |
K1=9.1×10-8 K2=1.1×10-12 |
| H2CO3 | H2CO3?H++HCO3- HCO3-?H++CO32- |
K1=4.31×10-7 K2=5.61×10-11 |
| H3PO4 | H3PO4?H++H2PO4- H2PO4-?H++HPO42- HPO42-?H++PO43- |
K1=7.1×10-3 K2=6.3×10-8 K3=4.2×10-13 |
对于弱酸,在一定温度下达到电离平衡时,各微粒的浓度存在一种定量的关系.下表是25℃时几种常见弱酸的电离平衡常数
| 酸 | 电离方程式 | 电离平衡常数K |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
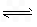 H++A-,则K=
H++A-,则K=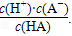 式中:K为电离平衡常数,只与温度有关,c为各粒子的平衡浓度.下表是几种常见弱酸的电离平衡常数(25℃).
式中:K为电离平衡常数,只与温度有关,c为各粒子的平衡浓度.下表是几种常见弱酸的电离平衡常数(25℃). 
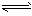 H++A-,则电离平衡常数
H++A-,则电离平衡常数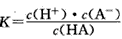 ,K只与温度有关,c为各微粒的平衡浓度。下表是25℃时几种常见弱酸的电离平衡常数。
,K只与温度有关,c为各微粒的平衡浓度。下表是25℃时几种常见弱酸的电离平衡常数。 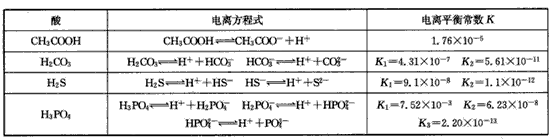
 H++A-,则K=
H++A-,则K= 。式中:K为电离平衡常数,只与温度有关,c为各微粒的平衡浓度。下表是几种常见弱酸的电离平衡常数(25 ℃)
。式中:K为电离平衡常数,只与温度有关,c为各微粒的平衡浓度。下表是几种常见弱酸的电离平衡常数(25 ℃)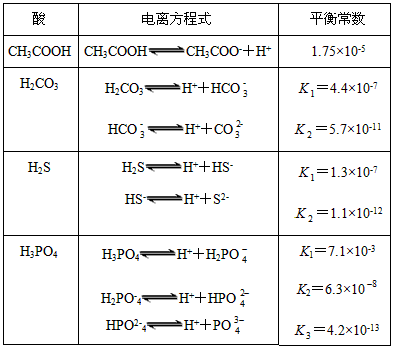
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com