
题目列表(包括答案和解析)
用如图装置测定水中氢、氧元素的质量比,其方法是分别测定通氢气前后玻璃管的质量差和U形管的质量差,实验测得m(H)∶m(O)>1∶8。下列对导致这一结果的原因的分析中,一定错误的是( )
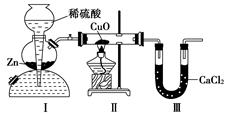
A.Ⅰ、Ⅱ装置之间缺少干燥装置
B.CuO没有全部被还原
C.Ⅱ 装置中玻璃管内有水冷凝
D.Ⅲ装置后缺少干燥装置
用如下图装置测定水中氢、氧元素的质量比,其方法是分别测定通氢气前后玻璃管的质量差和U形管的质量差,实验测得m(H)∶m(O)>1∶8。下列对导致这一结果的原因的分析中,一定错误的是( )

A.Ⅰ、Ⅱ装置之间缺少干燥装置
B.Ⅲ装置后缺少干燥装置
C.Ⅱ装置中玻璃管内有水冷凝
D.CuO没有全部被还原
⑴(8分)甲、乙两个实验小组分别进行“测定Na2CO3和NaCl混合物中Na2CO3含量”的实验。
甲组:沉淀分析法
把一定量的混合物溶解后加入过量CaCl2,然后将所得沉淀过滤、洗涤、烘干、称量,所得固体是 (填化学式);写出该反应的离子方程式________________________ __。
 乙组:气体分析法
乙组:气体分析法
把一定量的混合物与足量盐酸反应后,用如图装置测定产生的CO2气体的体积,为减小CO2的溶解,B中溶液应是_________________,(将选项填入空格中)
A.氢氧化钠溶液 B.饱和氯化钠溶液 C.饱和碳酸氢钠溶液
选用该溶液后实验结果还是不准确,原因是_________________________________。
⑵(5分)某实验小组对中学课本中可生成氢气的反应进行了研究,总结出三个可以生成H2的反应:
① Zn+盐酸;② Na+水;③ Al+NaOH溶液。为点燃上述三个反应生成的H2,他们设计了如下图(原实验)所示的装置图,请回答下列问题:
①写出Al和NaOH溶液反应的化学方程式 。
② 实验小组在点燃用此装置制得的H2时,①③实验获得成功,②却失败了。他们分析认为失败的原因是Na与H2O的反应速率太快,Na的用量又太少。于是他们准备增加钠的用量,可老师说太危险,你认为产生危险的原因是 。
③ 实验小组查阅钠、苯(一种不溶于水的液态有机物)、水的密度分别为0.97g/mL、0.88g/mL、1.00g/mL,并据此对实验进行了改进。

在改进后的实验中H2的生成速率减慢。原因是 。
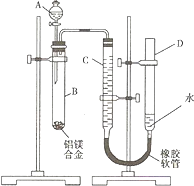 某学习小组用如图装置测定铝镁合金中铝的质量分数和铝的相对原子质量.A中为NaOH溶液.
某学习小组用如图装置测定铝镁合金中铝的质量分数和铝的相对原子质量.A中为NaOH溶液.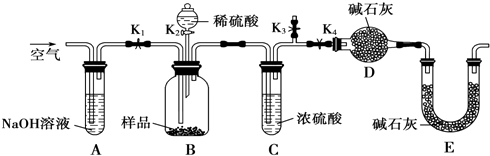
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com