
题目列表(包括答案和解析)
(8分)将一定量的SO2和含0.7mol O2的空气(忽略CO2)放入一定体积的密闭容器中,550℃时,在催化剂作用下发生反应:2SO2(g)+O2(g)
 2SO3(g)(正反应放热)。反应达到平衡后,将容器中的混合气体通过过量的NaOH溶液,气体体积减少了21.28L;再将剩余气体通过焦性没食子酸的碱性溶液吸收O2,气体的体积又减少了5.6L(以上气体体积均为标准状况下的体积)。(以下计算结果均保留一位小数)
2SO3(g)(正反应放热)。反应达到平衡后,将容器中的混合气体通过过量的NaOH溶液,气体体积减少了21.28L;再将剩余气体通过焦性没食子酸的碱性溶液吸收O2,气体的体积又减少了5.6L(以上气体体积均为标准状况下的体积)。(以下计算结果均保留一位小数)
请回答下列问题:
(1)判断该反应达到平衡状态的标志是 。
A.SO2和SO3的浓度相等
B.SO2的百分含量保持不变
C.容器中气体的压强不变
D.SO3的生成速率与SO2的消耗速率相等E.容器中混合气体的密度保持不变
(2)欲提高SO2的转化率,下列措施可行的是 。
A.向装置中再充入N2 B.向装置中再充入O2
C.改变反应的催化剂 D.升高体系温度
(3)求该反应达到平衡时SO2的转化率(用百分数表示) 。
(4)若将平衡混合气体的5%通入过量的BaCl2溶液中,则生成 克沉淀。
将一定量的SO2和含0.7mol O2的空气(忽略CO2)放入一定体积的密闭容器中,550℃时,在催化剂作用下发生反应:2SO2(g)+O2(g) ![]() 2SO3(g)(正反应放热)。反应达到平衡后,将容器中的混合气体通过过量的NaOH溶液,气体体积减少了21.28L;再将剩余气体通过焦性没食子酸的碱性溶液吸收O2,气体的体积又减少了5.6L(以上气体体积均为标准状况下的体积)。(以下计算结果均保留一位小数)
2SO3(g)(正反应放热)。反应达到平衡后,将容器中的混合气体通过过量的NaOH溶液,气体体积减少了21.28L;再将剩余气体通过焦性没食子酸的碱性溶液吸收O2,气体的体积又减少了5.6L(以上气体体积均为标准状况下的体积)。(以下计算结果均保留一位小数)
请回答下列问题:
(1)判断该反应达到平衡状态的标志是 。
A.SO2和SO3的浓度相等 B.SO2的百分含量保持不变
C.容器中气体的压强不变 D.SO3的生成速率与SO2的消耗速率相等E.容器中混合气体的密度保持不变
(2)欲提高SO2的转化率,下列措施可行的是 。
A.向装置中再充入N2 B.向装置中再充入O2
C.改变反应的催化剂 D.升高体系温度
(3)求该反应达到平衡时SO2的转化率(用百分数表示) 。
(4)若将平衡混合气体的5%通入过量的BaCl2溶液中,则生成 克沉淀。
| |||||||||||||||||||||||||||||||||||||||
已知:①N2(g)+O2(g)=2NO(g) ΔH1=+180 kJ·mol-1
②N2(g)+3H2(g)  2NH3(g) ΔH2=-92.4 kJ·mol-1
2NH3(g) ΔH2=-92.4 kJ·mol-1
③2H2(g)+O2(g)=2H2O(g) ΔH3=-483.6 kJ·mol-1
下列说法正确的是( )
A.反应②中的能量变化如图所示,则ΔH2=E1-E3
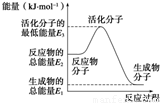
B.H2的燃烧热为241.8 kJ·mol-1
C.由反应②知在温度一定的条件下,在一恒容密闭容器中通入1 mol N2和3 mol H2,反应后放出的热量为Q1 kJ,若通入2 mol N2和6 mol H2充分反应后放出的热量为Q2 kJ,则184.8>Q2>2Q1
D.氨的催化氧化反应为4NH3(g)+5O2(g)=4NO(g)+6H2O(g) ΔH=+906 kJ·mol-1
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com