
题目列表(包括答案和解析)
| 序号 | 分解水的过程 | 平衡常数 | T=2500K | T=3000K |
| A | H2O(g)?HO(g)+H(g) | K1 | 1.34×10-4 | 8.56×10-3 |
| B | HO(g)?H(g)+O(g) | K2 | 4.22×10-4 | 1.57×10-2 |
| C | 2H(g)?H2(g) | K3 | 1.52×103 | 3.79×10 |
| D | 2O(g)?O2(g) | K4 | 4.72×103 | 7.68×10 |
| 1 |
| 2 |
| 1 |
| 2 |
| 1 |
| 2 |
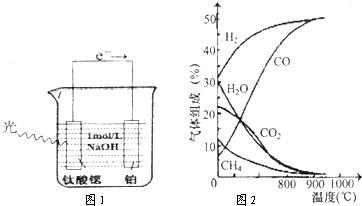
(11分)
(1)已知H2(g)+Br2(1)2HBr(g) △H=-72kJ/mol,蒸发1mol Br2(1)需要吸收的能量为30kJ,其它相关数据如下表:
|
|
H2(g) |
Br2(g) |
HBr(g) |
|
键能/kJ·mol-1 |
436 |
a |
369 |
①Br2(1)=Br2(g) △H1,则△H1=_____________;
②写出H2(g)与Br2(g)反应生成HBr(g)的热化学方程式:_____________________________
③试计算a=_________________。
(2)磷在氧气中燃烧,可能生成两种固态氧化物。3.1g的单质磷(P)在一定量氧气中燃烧生成P2O3、P2O5各0.025mol,反应物完全耗尽,并放出X kJ热量。
①已知1mol磷完全燃烧生成稳定氧化物放出的热量为Y kJ,则1molP与O2反应生成固态P2O3的反应热△H=________________________________。
②写出1mol P与O2反应生成固态P2O3的热化学方程式:
___________________________________________________________________
 H2(g)+1/2O2(g),平衡常数K=___(用含K1、K2、K3、K4的式子表示)。
H2(g)+1/2O2(g),平衡常数K=___(用含K1、K2、K3、K4的式子表示)。 H2 (g) +1/2O2 ( g) △H=-___kJ/mol。
H2 (g) +1/2O2 ( g) △H=-___kJ/mol。 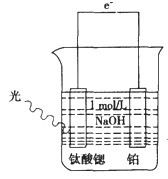
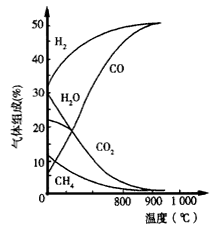

(11分)
(1)已知H2(g)+Br2(1) 2HBr(g) △H=-72kJ/mol,蒸发1mol Br2(1)需要吸收的能量为30kJ,其它相关数据如下表:
2HBr(g) △H=-72kJ/mol,蒸发1mol Br2(1)需要吸收的能量为30kJ,其它相关数据如下表:
| | H2(g) | Br2(g) | HBr(g) |
| 键能/kJ·mol-1 | 436 | a | 369 |
 l磷完全燃烧生成稳定氧化物放出的热量为Y kJ,则1molP与O2反应生成固态P2O3的反应热△H=________________________________。
l磷完全燃烧生成稳定氧化物放出的热量为Y kJ,则1molP与O2反应生成固态P2O3的反应热△H=________________________________。湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com