
题目列表(包括答案和解析)
 一定条件下,在体积为3L的密闭容器中,一氧化碳与氢气反应生成甲醇(催化剂为Cu2O/ZnO):CO(g)+2H2(g)?CH3OH(g).根据题意完成下列问题:
一定条件下,在体积为3L的密闭容器中,一氧化碳与氢气反应生成甲醇(催化剂为Cu2O/ZnO):CO(g)+2H2(g)?CH3OH(g).根据题意完成下列问题:| c(CH3OH) |
| c(CO)?C 2(H2) |
| c(CH3OH) |
| c(CO)?C 2(H2) |
| 2nB |
| 3tB |
| 2nB |
| 3tB |
| 1 |
| 2 |
| n(H2) |
| n(CH3OH) |
 2Cu+CO2
2Cu+CO2 2Cu+CO2
2Cu+CO2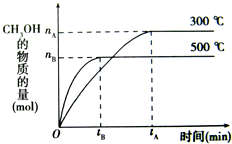 一定条件下,在体积为3L的密闭容器中化学反应CO(g)+2H2(g)-CH3OH(g)达到平衡状态.
一定条件下,在体积为3L的密闭容器中化学反应CO(g)+2H2(g)-CH3OH(g)达到平衡状态.| c(CH3OH) |
| c(CO)×c2(H2) |
| c(CH3OH) |
| c(CO)×c2(H2) |
| nB |
| 3tB |
| nB |
| 3tB |
 (1)化学平衡常数K表示可逆反应的进行程度,K值越大,表示
(1)化学平衡常数K表示可逆反应的进行程度,K值越大,表示 一定条件下,在体积为3L的密闭容器中,一氧化碳与氢气反应生成甲醇(催化剂为Cu2O/ZnO):CO(g)+2H2(g)?CH3OH(g)
一定条件下,在体积为3L的密闭容器中,一氧化碳与氢气反应生成甲醇(催化剂为Cu2O/ZnO):CO(g)+2H2(g)?CH3OH(g)| c(CH3OH) |
| c(CO)?c2(H2) |
| c(CH3OH) |
| c(CO)?c2(H2) |
| 2nB |
| 3tB |
| 2nB |
| 3tB |
| 1 |
| 2 |
 (2011?巢湖二模)一定条件下,在体积为3L的密闭容器中,一氧化碳与氢气反应生成甲醇的反应(催化剂为Cu2O/ZnO):CO(g)+2H2(g)
(2011?巢湖二模)一定条件下,在体积为3L的密闭容器中,一氧化碳与氢气反应生成甲醇的反应(催化剂为Cu2O/ZnO):CO(g)+2H2(g) CH3OH(g),结合右图判断下列说法正确的是( )
CH3OH(g),结合右图判断下列说法正确的是( )湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com