
题目列表(包括答案和解析)
(6分)(1)将NaBiO3固体(黄色微溶)加入到MnSO4和H2SO4的混合溶液里加热,固体溶解变为澄清溶液,发生如下反应:
NaBiO3 + MnSO4 + H2SO4===Na2SO4 + Bi2(SO4)3 + NaMnO4 + H2O
①上述反应中还原产物是 ,若有2mol氧化剂在该反应中被还原,则生成的MnO4-被还原为Mn2+时,能将 molHCl氧化成Cl2;
② 写出NaBiO3固体溶于浓盐酸产生黄绿色气体的化学反应方程式 。
(2)用H2O2和H2SO4的混合溶液可溶出印刷电路板金属粉末中的铜。已知:
Cu(S)+2H+(aq)=== Cu2+(aq)+H2(g) ΔH=64.39kJ·mol-1
2H2O2(L)===2H2O(L)+O2(g) ΔH=-196.46kJ·mol-1
H2(g)+ O2(g)===H2O(L) ΔH=-285.84kJ·mol-1
在H2SO4溶液中Cu与H2O2反应生成Cu2+和H2O的热化学方程式为 。
 ?
?
(1)在实验室用集气瓶收集气体G和气体H。则收集气体G的方法是 ,检验气体H已收集满的方法是 。?
(2)在实验室进行操作①时,除了使用酒精灯、铁架台、铁圈及夹持仪器外,还缺少的玻璃仪器是 ,在进行操作②时,应在HCl的气氛中加热脱水,其目的是 。?
(3)F位于元素周期表第? ?周期? ?族,写出其最高价氧化物对应的水化物的电子式? ?。写出反应A+H2O→B+H的化学方程式 。?
(4)某学生设计如图15-38装置,将产生的气体H通入硫酸铜溶液,制得深蓝色溶液J。现有下列?试剂?:?
 ?
?
图15-38
①稀NaOH溶液 ②H2O2溶液 ?③浓氨水 ?④NH4Cl?溶液 ⑤生石灰 ?⑥消石灰 ⑦碳酸氢钠?
(Ⅰ)a中的试剂:固体X应是? ?(填序号),溶液Y应是 (填序号)。
(Ⅱ)你认为使用装置b时存在的主要缺点: (用简明文字叙述)。?
抗击“非典”期间,过氧乙酸是广为使用的消毒剂,它可由H2O2和、冰醋酸反应制取,所以在过氧乙酸中常含有残留的H2O2。测定产品中过氧乙酸浓度c0涉及下列反应:
① MnO4- +
MnO4- + H2O2 +
H2O2 + H+ ═
H+ ═ Mn2+ +
Mn2+ + O2 +
O2 +  H2O
H2O
② H2O2 + 2I- + 2 H+ ═ I2 + 2 H2O
③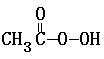 + 2I- + 2 H+ ═ CH3COOH + I2 + 2 H2O
+ 2I- + 2 H+ ═ CH3COOH + I2 + 2 H2O
④I2 + 2S2O32- ═ S4O62- + 2 I-
请回答下列问题:
(1)配平反应①的离子方程式: MnO4- +
MnO4- + H2O2 +
H2O2 + H+ ═
H+ ═  Mn2++
Mn2++  O2 +
O2 +  H2O
H2O
(2)用Na2S2O3标准溶液滴定I2是(反应④)选用的指示剂是 。
(3)取b0mL待测液,用硫酸使溶液酸化,再用浓度为a1mol·L-1的KMnO4标准溶液滴定其中的H2O2,耗用的KMnO4体积为b1mL(反应①,滴定过程中KMnO4不与过氧乙酸反应)。
另取b0mL待测液,加入过量的KI,并用硫酸使溶液酸化,此时过氧乙酸和残留的H2O2都能跟KI反应生成I2(适应②和③)。再用浓度为a2mol·L-1的Na2S2O3标准溶液滴定生成的I2,,耗用Na2S2O3的体积为b2mL。
请根据上述实验数据计算过氧乙酸的浓度(用含a1、a2、 b1 、b2、b0的代数表示)
c0 = .
(4)为计算待测液中过氧乙酸的浓度c0,加入的KI的质量已过量但没有
准确称量,是否影响测定结果 (填是或否)。
抗击“非典”期间,过氧乙酸是广为使用的消毒剂,它可由H2O2和、冰醋酸反应制取,所以在过氧乙酸中常含有残留的H2O2。测定产品中过氧乙酸浓度c0涉及下列反应:
① MnO4-
+
MnO4-
+ H2O2
+
H2O2
+ H+
═
H+
═ Mn2+ +
Mn2+ + O2
+
O2
+  H2O
H2O
② H2O2 + 2I- + 2 H+ ═ I2 + 2 H2O
③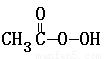 + 2I-
+ 2 H+ ═ CH3COOH + I2
+ 2 H2O
+ 2I-
+ 2 H+ ═ CH3COOH + I2
+ 2 H2O
④I2 + 2S2O32- ═ S4O62- + 2 I-
请回答下列问题:
(1)配平反应①的离子方程式:
 MnO4-
+
MnO4-
+ H2O2
+
H2O2
+ H+
═
H+
═  Mn2++
Mn2++
 O2 +
O2 +  H2O
H2O
(2)用Na2S2O3标准溶液滴定I2是(反应④)选用的指示剂是 。
(3)取b0mL待测液,用硫酸使溶液酸化,再用浓度为a1mol·L-1的KMnO4标准溶液滴定其中的H2O2,耗用的KMnO4体积为b1mL(反应①,滴定过程中KMnO4不与过氧乙酸反应)。
另取b0mL待测液,加入过量的KI,并用硫酸使溶液酸化,此时过氧乙酸和残留的H2O2都能跟KI反应生成I2(适应②和③)。再用浓度为a2mol·L-1的Na2S2O3标准溶液滴定生成的I2,,耗用Na2S2O3的体积为b2mL。
请根据上述实验数据计算过氧乙酸的浓度(用含a1、a2、 b1 、b2 、b0的代数表示)
c0 = .
(4)为计算待测液中过氧乙酸的浓度c0,加入的KI的质量已过量但没有
准确称量,是否影响测定结果 (填是或否)。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com