
题目列表(包括答案和解析)

实验室常利用甲醛法测定
(NH4)2SO4样品中氮的质量分数,其反应原理为:4NH4++6HCHO 3H++6H2O+(CH2)6N4H+(
3H++6H2O+(CH2)6N4H+(
步骤Ⅰ
称取1.500 g样品,加水溶解,配成250 mL溶液.步骤
Ⅱ 用酸式滴定管量取25.00 mL样品溶液于250 mL锥形瓶中,加入10 mL 20%的中性甲醛溶液,摇匀、静置5 min后,加入1~2滴酚酞试液.用0.1010 mol·L-1的NaOH标准溶液滴定至终点.按上述操作方法再重复2次.(1)根据实验步骤填空:
①步骤
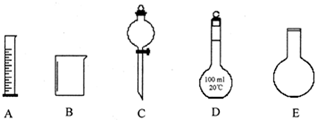
Ⅰ中用到的主要玻璃仪器有________.②
下列情况使样品中氮质量分数偏低的是________.a.
步骤Ⅱ中酸式滴定管用蒸馏水洗涤后,直接加入样品溶液进行量取b.锥形瓶用蒸馏水洗涤后,水未倒尽
c.滴定时对NaOH标准溶液体积,读取初读数时仰视,读取终读数时姿势正确
d.滴定管在滴定前有气泡,滴定后气泡消失
③滴定达到终点的现象________.
(2)滴定结果如表所示:
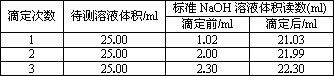
则消耗NaOH标准溶液的体积平均为________,该样品中氮的质量分数为________.

(12分)环己酮是一种重要的化工原料,实验室常用下列方法制备环己酮:
环己醇、环己酮和水的部分物理性质见下表:
| 物质 | 沸点(℃) | 密度(g-cm-3,20℃) | 溶解性 |
| 环己醇 | 161.1(97.8)* | 0.9624 | 能溶于水 |
| 环己酮 | 155.6(95)* | 0.9478 | 微溶于水 |
| 水 | 100.0 | 0.9982 |
|
*括号中的数据表示该有机物与水形成的具有固定组成的混合物的沸点
(1)酸性Na2Cr2O7溶液氧化环己醇为放热反应,反应剧烈将导致体系温度迅速上升,副反应增多。实验中将酸性Na2Cr2O7溶液加到盛有环己醇的烧瓶中,在55-60℃进行反应。反应完成后,加入适量水,蒸馏,收集95-100℃的馏分,得到主要的含环己酮和水的混合物。
①酸性Na2Cr2O7溶液的加料方式为 。
②蒸馏不能分离环己酮和水的原因是 。
(2)环己酮的提纯需要经过以下一系列的操作:
a蒸馏,收集151-156℃的馏分;
b 过滤;
c 在收集到的馏分中加NaCl固体至饱和,静置,分液;
d 加入无水MgSO4固体,除去有机物中少量水。
①上述操作的正确顺序是 (填字母)。
②上述操作b、c中使用的玻璃仪器除烧杯、锥形瓶、玻璃棒外,还需 、 。
③在上述操作c中,加入NaCl固体的作用是 。
(3)利用核磁共振氢谱可以鉴定制备的产物是否为环己酮,环己酮分子中有 种不同化学环境的氢原子。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com