
题目列表(包括答案和解析)
计算
(1) 在25℃时,Ksp(AgBr) = c(Ag+)·c(Br-)=1.0×10-12 ,若取0.188 g的AgBr(相对分子质量188)固体放入100 mL水中(忽略溶液体积的变化),则溶液中Br-的物质的量浓度为 .
(2)在某温度下,重水(D2O)的离子积常数为1×10-12 . 若用PH一样的定义来规定PD值,则PD=-lg{C(D+)} ,1L溶有0.01mol的NaOD的D2O溶液,其PD= ;
(3) 在定容容器内加入一定量A(g),发生反应2A(g) ![]() B(g)+xC(g),在一定条件下从开始达到平衡后,压强增大了p %时,A的转化率也为p % ,则x的值为 .
B(g)+xC(g),在一定条件下从开始达到平衡后,压强增大了p %时,A的转化率也为p % ,则x的值为 .
(4)已知在25℃时,醋酸的Ka = 1.75×10-5 .在此温度下,0.2 moL/L醋酸与0.1 mol/L NaOH
溶液等体积混合后,溶液显 性, 此溶液中离子浓度大到小的顺序是 .
下列叙述正确的是
A.已知I3- I2+I-,向盛有KI3溶液的试管中加入适量CCl4,振荡静置后CCl4层显紫红色,说明KI3在CCl4中的溶解度比在水中的大
I2+I-,向盛有KI3溶液的试管中加入适量CCl4,振荡静置后CCl4层显紫红色,说明KI3在CCl4中的溶解度比在水中的大
B.室温下向10mL pH =3的醋酸溶液中加水稀释后,溶液中 减小
减小
C.室温时ka(HF)=3.6×10-4,ka(CH3COOH)=1.75×10-5,0.1 mol /L的NaF溶液与0.1 mol /L的CH3COOK溶液相比,一定有c(Na+) -c(F-)<c(K+)-c(CH3COO-)成立
D.在25℃时,将amol/L的氨水与0.01 mol/L的盐酸等体积混合,充分反应后溶液中c(NH4+)=c(Cl-),则25℃时NH3 • H2O的电离常数Kb=
下列叙述正确的是
A.已知I3- I2+I-,向盛有KI3溶液的试管中加入适量CCl4,振荡静置后CCl4层显紫红色,说明KI3在CCl4中的溶解度比在水中的大 I2+I-,向盛有KI3溶液的试管中加入适量CCl4,振荡静置后CCl4层显紫红色,说明KI3在CCl4中的溶解度比在水中的大 |
B.室温下向10mL pH =3的醋酸溶液中加水稀释后,溶液中 减小 减小 |
| C.室温时ka(HF)=3.6×10-4,ka(CH3COOH)=1.75×10-5,0.1 mol /L的NaF溶液与0.1 mol /L的CH3COOK溶液相比,一定有c(Na+) -c(F-)<c(K+)-c(CH3COO-)成立 |
D.在25℃时,将amol/L的氨水与0.01 mol/L的盐酸等体积混合,充分反应后溶液中c(NH4+)=c(Cl-),则25℃时NH3 ? H2O的电离常数Kb=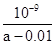 |
A.已知I3- I2+I-,向盛有KI3溶液的试管中加入适量CCl4,振荡静置后CCl4层显紫红色,说明KI3在CCl4中的溶解度比在水中的大 I2+I-,向盛有KI3溶液的试管中加入适量CCl4,振荡静置后CCl4层显紫红色,说明KI3在CCl4中的溶解度比在水中的大 |
B.室温下向10mL pH =3的醋酸溶液中加水稀释后,溶液中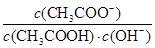 减小 减小 |
| C.室温时ka(HF)=3.6×10-4,ka(CH3COOH)=1.75×10-5,0.1 mol /L的NaF溶液与0.1 mol /L的CH3COOK溶液相比,一定有c(Na+) -c(F-)<c(K+)-c(CH3COO-)成立 |
D.在25℃时,将amol/L的氨水与0.01 mol/L的盐酸等体积混合,充分反应后溶液中c(NH4+)=c(Cl-),则25℃时NH3 ? H2O的电离常数Kb=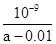 |
有FeSO4、Fe2(SO4)3、CuSO4的混合溶液600 mL,其中c(SO2-4)=0.1 mol·L-1,投入一些锌粉,反应后得到的固体沉淀中经测定含有Cu、Fe,但不含Zn,溶液中含有0.01 mol Fe2+。据此可知投入的锌粉的质量是( )
A.13 g
B.9.75 g
C.6.5 g
D.3.25 g
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com