
题目列表(包括答案和解析)

25℃时,向10ml0.01mol/LKOH溶液中滴加0.01mol/L苯酚溶液,混合溶液中粒子浓度关系正确的
| A.pH>7时,c(C6H5O-)>c(K+)>c(H+)>c(OH-) |
| B.pH<7时,c(K+)>c(C6H5O-)>c(H+)>c(OH-) |
| C.V[C6H5OH(aq)]=10ml时,c(K+)=c(C6H5O-)>c(OH-)=c(H+) |
| D.V[C6H5OH(aq)]=20ml时,c(C6H5O-)+c(C6H5OH)=2c(K+) |
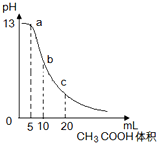 25℃时,向体积为10mL0.1mol/L NaOH溶液中逐滴加入0.1mol/L的CH3COOH溶液,曲线如图所示,有关离子浓度关系的比较中,错误的是( )
25℃时,向体积为10mL0.1mol/L NaOH溶液中逐滴加入0.1mol/L的CH3COOH溶液,曲线如图所示,有关离子浓度关系的比较中,错误的是( )运用反应原理研究氮、硫、氯、碘及其化合物的反应有重要意义。
(1)在反应:2SO2(g)+O2(g) 2SO3(g)的混合体系中,SO3的百分含量和温度的关系如下图(曲线上任何一点都表示平衡状态):
2SO3(g)的混合体系中,SO3的百分含量和温度的关系如下图(曲线上任何一点都表示平衡状态):

①2SO2(g)+O2(g) 2SO3(g)的△H
0(填“>”或“<”);若在恒温、恒压时,向该平衡体系中通入氦气平衡将
移动(填“向左”、“向右”或“不”);
2SO3(g)的△H
0(填“>”或“<”);若在恒温、恒压时,向该平衡体系中通入氦气平衡将
移动(填“向左”、“向右”或“不”);
②当温度为T1,反应进行到状态D时,V正 V逆(填“>”、“<”或“=”)。
(2)①下图是一定条件下,N2和H2发生可逆反应生成1mol NH3的能量变化图,该反应的热化学反应方程式 。(△H用含Q1、Q2的代数式表示)

②25°C时,将a mol • L―1的氨水与b mol • L―1的盐酸等体积混合,所得溶液的pH=7,则c (NH4+) c(Cl―),a b(填“>”、“<”或“=”);
(3)海水中含有大量以化合态形式存在的氯、碘元素。已知:250C时,Ksp(AgCl)=1.6×10―10mol2•L―2、Ksp(AgI)=1.5×10―16mol2•L―2。
在 250C时,向 10mL0.002mol•L―1 的 NaCl 溶液中滴入 10mL0.002mol•L―1AgNO3溶液, 有白色沉淀生成,向所得浊液中继续滴人0.1mol •L―1的NaI溶液,白色沉淀逐渐转化为黄色沉淀,其原因是 ,该反应的离子方程式 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com