
题目列表(包括答案和解析)
下图所示装置中,甲、乙、丙三个烧杯依次分别盛放足量的HCl溶液、CuSO4溶液和K2SO4溶液,电极均为石墨电极。
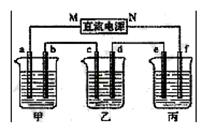
(1)接通电源后,观察到甲中b电极上产生刺激性气味气体。据此回答问题:
① 电源的N端为_____ 极;
② 电极c上的现象为_____________________________;
③ 电极f上的电极反应式为__________________________________;
④ 乙中加入_______________________,可使其恢复至原溶液。
(2)若丙中盛装19g质量分数为10%的K2SO4溶液,当电极b上产生的刺激性气味气体在标准状况下的体积为11.2L时,则丙中质量分数变为:_________________;(过程中无晶体析出)
(3)如果乙装置电解过程中铜全部析出,此时电解能否继续进行,_______________。为什么?
(10分)下图所示装置中,甲、乙、丙三个烧杯依次分别盛放100 g 5.00%的NaOH溶液、足量的CuSO4溶液和100 g 10.00%的K2SO4溶液,电极均为石墨电极。


 (1)接通电源,经过一段时间后,测得丙中K2SO4浓度为10.47%,乙中c电极质量增加。
(1)接通电源,经过一段时间后,测得丙中K2SO4浓度为10.47%,乙中c电极质量增加。
据此回答问题: ①电源的N端为 极;
①电源的N端为 极; ②电极b上发生的电极反应为 ;
②电极b上发生的电极反应为 ; ③电极b上生成的气体在标准状况下的体积:
③电极b上生成的气体在标准状况下的体积:
 ④电极c的质量变化是 g;
④电极c的质量变化是 g; (2)如果电解过程中铜全部析出,此时电解能否继续进行,为什么?
(2)如果电解过程中铜全部析出,此时电解能否继续进行,为什么?  。
。 ⑤电解前后各溶液的pH如何变化。(填增大,减小或不变)
⑤电解前后各溶液的pH如何变化。(填增大,减小或不变) 甲溶液 ;
甲溶液 ; 乙溶液_______;
乙溶液_______; 丙溶液_______;
丙溶液_______;
(24分)(1)如右图所示,用两根质量相等的银棒作电极电解CuCl2溶液,电解一段时间后,①现象为 ,
②a、b两极比较, 极重,写出a极上发生的反应 。
(2)下图所示装置中,甲、乙、丙三个烧杯依次分别盛放100g5.00%的NaOH溶液、足量的CuSO4溶液和100g10.00%的K2SO4溶液,电极均为石墨电极。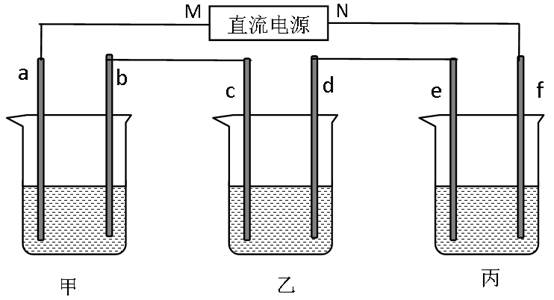
I.接通电源,经过一段时间后,测得丙中K2SO4的浓度变为10.47%,乙中c电极质量增加。据此回答下列问题。
①电源的N端为 极;
②电极b上发生的电极反应为: 。
③电极b上生成的气体在标准状况下的体积为: L。
④电极c的质量变化是: g。
⑤电解前后各溶液的酸、碱性大小是否发生变化,简述其原因:
甲溶液: , 。
乙溶液: , 。
丙溶液: , 。
II.如果电解过程中铜全部析出,此时电解能否继续进行,为什么?
, 。
(14分)下图所示装置中,甲、乙、丙三个烧杯依次分别盛放100 5.00%的
5.00%的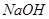 溶液、足量的
溶液、足量的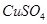 溶液和l00
溶液和l00 10.00%的
10.00%的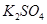 溶液.电极均为石墨电极。接通电源,经过一段时间后,测得丙中
溶液.电极均为石墨电极。接通电源,经过一段时间后,测得丙中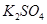 浓度为10.47%,乙中c电极质量增加。据此回答问题:
浓度为10.47%,乙中c电极质量增加。据此回答问题: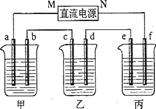
①电源的N端为 极;
②电极b上发生的电极反应为 ;
③电极b上生成的气体在标准状况下的体积: ;④电极c的质量变化是 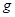 ;
;
⑤电解前后各溶液的酸、碱性大小是否发生变化,简述其原因:
甲溶液 ;
乙溶液 ;
丙溶液 ;
. 下图所示装置中,甲、乙、丙三个烧杯依次分别盛放NaOH溶液、CuSO4溶液和K2SO4溶液,电极均为石墨电极。
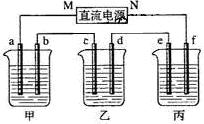
接通电源,经过一段时间后,测得乙中c电极质量增加了16g。据此回答下列问题:
(1)电极b上发生的电极反应为 ;
(2)计算电极e上生成的气体在标准状态下的体积: ;
(3)电解后甲溶液的pH (填“增大”、“减小”或“不变”) ,简述其原因: ;
(4)如果电解过程中铜全部析出,此时电解能否继续进行,为什么?
。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com