
题目列表(包括答案和解析)
20-I(6分)下列叙述正确的是
A.合成氨的“造气”阶段会产生废气
B.电镀的酸性废液用碱中和后就可以排放
C.电解制铝的过程中,作为阳极材料的无烟煤不会消耗
D.使用煤炭转化的管道煤气比直接燃煤可减少环境污染
 I.在恒温条件下将一定量X和Y的混合气体通入一容积为2L的密闭容器中,
I.在恒温条件下将一定量X和Y的混合气体通入一容积为2L的密闭容器中, 2X
2X 2X
2X 2Z2 在反应过程中的反应速率(?)与时间(t)的关系曲线,下列叙述正确的是
2Z2 在反应过程中的反应速率(?)与时间(t)的关系曲线,下列叙述正确的是
 2SO3 的两个素材:
2SO3 的两个素材:

I.在恒温条件下将一定量X和Y的混合气体通入一容积为2 L的密闭容器中,X和Y两物质的浓度随时间变化情况如下图。

(1)该反应的化学方程式为(反应物或生成物用符号X、Y表示): 。
(2)a、b、c、d四个点中,表示化学反应处于平衡状态的点是 。
II.下图是可逆反应X2 + 3Y2 ![]() 2Z2 在反应过程中的反应速率(??)与时间(t)的关系曲线,
2Z2 在反应过程中的反应速率(??)与时间(t)的关系曲线,
下列叙述正确的是
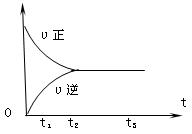
A、t1时,只有正方向反应
B、t2时,反应到达限度
C、t2- t3,反应不再发生
D、t2- t3,各物质的浓度不再发生变化
III.以下是关于化学反应2SO2 + O2 ![]() 2SO3 的两个素材:
2SO3 的两个素材:
素材1:某温度和压强下,2升容器中,不同时间点测得密闭体系中三种物质的物质的量

素材2:在不同条件下进行时SO2的转化率:(SO2的转化率是反应的SO2占起始SO2的百分数)

从以上的两个素材中体会:
(1)根据素材1中计算20-30s期间,用二氧化硫表示的化学反应的平均速率为: 。
(2)根据素材2中分析得到,提高该化学反应限度的途径有: 。
(3)根据素材1、素材2中分析得到,要实现素材1中SO2的转化率需控制的反应条件是 。
 2Z2 在反应过程中的反应速率(?)与时间(t)的关系曲线,下列叙述正确的是______.
2Z2 在反应过程中的反应速率(?)与时间(t)的关系曲线,下列叙述正确的是______.
 2SO3 的两个素材:
2SO3 的两个素材:


湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com