
题目列表(包括答案和解析)
34.下列关于钢铁腐蚀的叙述正确的是
A.钢铁插入水中,水下部分比空气与水交界处更容易腐蚀
B.钢铁在海水中比在河水中更易腐蚀,主要是由于海水中有大量电解质
C.钢铁设备上连接铜块可以防止钢铁腐蚀
D.钢铁设备与外加直流电源的负极相连可以防止钢铁腐蚀
33.科学家近年来研制出一种新型细菌燃料电池,利用细菌将有机物转化为氢气,氢气进入以磷酸为电解质的燃料电池发电。电池负极反应为:
A H2+2OH-=2H2O+2e- B O2+4H++4e-=2H2O
C H2=2H++2e- D O2+2H2O+4e-=4OH-
(7)理解金属发生电化学腐蚀的原因,金属腐蚀的危害,防止金属腐蚀的措施。
32.三氧化二镍(Ni2O3)可用于制造高能电池,其电解法制备过程如下:用NaOH调NiCl2溶液pH至7.5,加放适量硫酸钠后进行电解。电解过程中产生的Cl2在弱碱性条件下生成ClO-,把二价镍氧化为三价镍。以下说法正确的是
A 可用铁作阳极材料
B 电解过程中阳极附近溶液的pH升高
C 阳极反应方程式为:2Cl--2e-=Cl2
D 1mol二价镍全部转化为三价镍时,外电路中通过了1mol电子。
31.在原电池和电解池的电极上所发生的反应,同属氧化反应或同属还原反应的是
A、原电池的正极和电解池的阳极所发生的反应
B、原电池的正极和电解池的阴极所发生的反应
C、原电池的负极和电解池的阳极所发生的反应
D、原电池的负极和电解池的阴极所发生的反应
30.下列选项中说明乙醇作为燃料的优点的是( )①燃烧时发生氧化反应 ②充分燃烧的产物不污染环境 ③乙醇是一种再生能源 ④燃烧时放出大量热量
A.①②③ B.①②④ C.①③④ D.②③④
(6)了解原电池和电解池的工作原理,能写出电极反应和电池反应方程式。了解常见化学电源的种类及期工作原理。
29.在一定条件下,CO和CH4燃烧的热化学方程式分别为
2CO(g)+O2(g) 2CO2(g); △H=-566kJ·mol-1
CH4(g)+2O2(g) CO2(g)+2H2O(1); △H=-890kJ·mol-1
又知由H2与O2反应生成液态H2O 比生成气态H2O 多放出44kJ/mol的热量。则CH4 气体在空气中不完全燃烧热化学方程式正确的是
A.2CH4(g)+O2(g) CO2(g)+CO(g)+4H2O(1) △H=-1214kJ·mol-1
B.2CH4(g)+O2(g) CO2(g)+CO(g)+4H2O(g) △H=-1038kJ·mol-1
C.3CH4(g)+5O2(g) CO2(g)+2CO(g)+6H2O(1) △H=-1538kJ·mol-1
D.3CH4(g)+5O2(g) CO2(g)+2CO(g)+6H2O(g) △H=-1840kJ·mol-1
(5)了解能源是人类生存和社会发展的重要基础。了解化学在解决能源危机中的重要作用。
28.已知下列两个气态物质之间的反应:C2H2(g)+H2(g)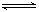 C2H4(g)……①,
C2H4(g)……①,
2CH4(g)
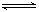 C2H4(g)+2H2(g)……②。
C2H4(g)+2H2(g)……②。
已知在降低温度时①式平衡向右移动,②式平衡向左移动,则下列三个反应:
C(s)+2H2(g) 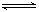 CH4(g) ;ΔH=-Q1……Ⅰ
CH4(g) ;ΔH=-Q1……Ⅰ
C(s)+1/2H2(g) 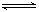 1/2C2H2(g);ΔH=-Q2……Ⅱ
1/2C2H2(g);ΔH=-Q2……Ⅱ
C(s)+H2(g) 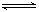 1/2C2H4(g);ΔH=-Q3 ……Ⅲ(Q1、Q2、Q3均为正值),“Q值”大小比较正确的是
1/2C2H4(g);ΔH=-Q3 ……Ⅲ(Q1、Q2、Q3均为正值),“Q值”大小比较正确的是
A.Q1>Q3>Q2 B.Q1>Q2>Q3 C.Q2>Q1>Q3 D.Q3>Q1>Q2
27.0.3mol的气态高能燃料乙硼烷B2H6在O2中燃烧,生成固态B2O3和液态H2O, 放出649.5kJ的热量。又知H2O(l) == H2O(g),ΔH=+44kJ/mol ;下列热化学方程式中,正确的是
(A)B2H6(g)+3O2(g)==B2O3(s)+3H2O(g),ΔH= -2165kJ /mol
(B)B2H6(g)+3O2(g)==B2O3(s)+3H2O(g),ΔH= -2033kJ /mol
(C)B2H6(g)+3O2(g)==B2O3+3H2O,ΔH= -2165kJ /mol
(D)B2H6(g)+O2(g)==B2O3(s)+H2O,ΔH= -2165kJ /mol
26.将V1mL1.0mol/L HCl溶液和V2mL未知浓度的NaOH溶液混合均匀后测量并记录溶液温度,实验结果如右图所示(实验中始终保持V1+V2=50mL)。下列叙述正确的是
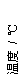
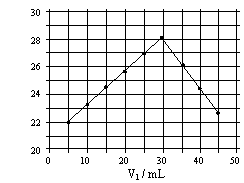 A 做该实验时环境温度为22℃
A 做该实验时环境温度为22℃
B 该实验表明化学能可能转化为热能
C NaOH溶液的浓度约为1.0mol/L
D 该实验表明有水生成的反应都是放热反应
(4)了解热化学方程式的含义,能用盖斯定律进行有关反应热的简单计算。
25.灰锡(以粉末状存在)和白锡是锡的两种同素异形体。已知:
①Sn(s、白)+2HCl(aq)=SnCl2(aq)+H2(g) △H1
②Sn(s、灰)+2HCl(aq)=SnCl2(aq)+H2(g) △H2
③Sn(s、灰)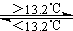 Sn(s、白) △H3=+2.1kJ/mol 下列说法正确的是
Sn(s、白) △H3=+2.1kJ/mol 下列说法正确的是
A △H1>△H2
B 锡在常温下以灰锡状态存在
C 灰锡转化为白锡的反应是放热反应
D 锡制器皿长期处于低于13.2℃的环境中,会自行毁坏
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com