
题目列表(包括答案和解析)
7.设C+CO2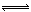 2CO,ΔH=+Q1 ,反应速度为V1
,N2+3H2≒2NH3,ΔH=-Q2 反应速度为V2,对于上述反应,当温度升高时,V1和V2的变化情况为
2CO,ΔH=+Q1 ,反应速度为V1
,N2+3H2≒2NH3,ΔH=-Q2 反应速度为V2,对于上述反应,当温度升高时,V1和V2的变化情况为
A.同时增大 B 同时减小 C 增大,减小 D 减小,增大
6.反应4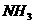 (气)+5
(气)+5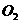 (气)
(气)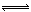 4NO(气)+6
4NO(气)+6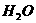 (气)在10L密闭容器中进行,半分钟后,水蒸气的物质的量增加了0.45mol,则此反应的平均速率
(气)在10L密闭容器中进行,半分钟后,水蒸气的物质的量增加了0.45mol,则此反应的平均速率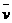 (X)(反应物的消耗速率或产物的生成速率)可表示为
(X)(反应物的消耗速率或产物的生成速率)可表示为
A. 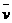 (NH3)=0.0100mol.L-1.s-1 B.
(NH3)=0.0100mol.L-1.s-1 B. 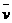 (O2)=0.0010mol.L-1.S-1
C.
(O2)=0.0010mol.L-1.S-1
C. 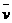 (NO)=0.0010mol.L-1.s-1 D.
(NO)=0.0010mol.L-1.s-1 D. 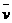 (H2O)=0.045mol.L-1.s-1
(H2O)=0.045mol.L-1.s-1
5.纯锌跟稀H2SO4反应速率很小,为了加快锌的溶解和放出H2的速率,并且使产生H2的量不变,当稀H2SO4过量时,可向其中加少量
A.CuSO4溶液 B.ZnSO4 C.铜 D.镁条
4.有a、b、c、d四种金属,将a与b用导线连结起来浸入电解质溶液中,b不易腐蚀.将a、d分别投入等浓度的盐酸中,d比a反应剧烈.将Cu浸入b的盐溶液里,无明显变化.如果把Cu浸入c的盐溶液里,有c的单质析出.据此判断它们的活动性由强到弱的顺序是
A.d、c、a、b B.d、a、b、c C.d、b、a、c D.b、a、d、c
3. 关于用水制取二级能源氢气,以下研究方向不可行的是
A.构成水的氢和氧都是可以燃烧的物质,因此可研究在水不分解的情况下,使氢气成为二级能源
B.设法将太阳能聚焦,产生高温,使水分解产生氢气
C.寻找高效催化剂,利用太阳能使水分解产生氢气
D.寻找特殊催化剂,用于开发廉价能源,以分解水制取氢气
2.下列说法正确的是
A. 需要加热方能发生的反应一定是吸热反应
B.放热的反应在常温下一定很容易发生
C.反应是放热还是吸热,必须看反应物和生成物所具有的总能量的相对大小
D.吸热反应在一定条件下也能发生
1.有人认为人体实际上是一架缓慢氧化着的“高级机器”,人体在生命过程中也需要不断的补充“燃料”。按照这种观点,你认为人们通常摄入的下列物质不能看作“燃料”的是
A.淀粉类物质 B.水 C.脂肪类物质 D.蛋白质
21.(9分)标准状况下的甲烷和一氧化碳的混合气体8.96L,其质量为7.60g,则混合气体平均相对分子质量为____________;混合气体中一氧化碳的体积为_________,甲烷的质量为___________。
|
(1)葡萄糖的摩尔质量为_________________。
(2)该溶液中含水________g。
该溶液的密度约为_______g·mL-1。
(3)该溶液的物质的量浓度为___________ mol·L-1
(精确到小数点后面两位)。
(4)血液中甘油三酯(假设其化学式为C55H104O6,M=860)的含量是人体健康重要参数。正常人的甘油三酯的含量为0. 8~2.2mmol/L。在某次体检中,测得某被检者血液的密度为0.99g·mL-1,血液中甘油三酯的质量分数为1.72‰,则该被检者甘油三酯的含量________(填“偏低”、“正常”、“偏高”或“无法确定”)。
20.(9分)解答下列各题。
(1)在标准状况下,0.5 mol H2的体积是_______,质量是______,分子数是__________。
(2)标准状况下,某气体的密度是1.25g/L,该气体的相对分子质量是_______。
(3)电解36g H2O可得到标准状况下的H2______L,O2_____L。
(4)在相同的温度和压强下,相同质量的CH4、O2两种气体的体积比为________;相同体积的两种气体的质量比为_________,物质的量比为__________。
19.(11分)实验室欲配制0.05 mol/L的NaOH溶液500 mL。有以下仪器:①烧杯、②100 mL量筒、③100 mL容量瓶、④500 mL容量瓶、⑤玻璃棒、⑥托盘天平(带砝码)
(1)配制时,必须使用的仪器有_______(填代号),还缺少的仪器是______________。该实验中两次用到玻璃棒,其作用分别是_____________________________,____________
________________。
(2)使用容量瓶前必须进行的一步操作是___________________________________________。
(3)配制溶液时,一般可以分为以下几个步骤:
①称量 ②计算 ③溶解 ④摇匀 ⑤转移 ⑥洗涤 ⑦定容
其正确的操作顺序为___________(用序号填写)。在①操作中需称量NaOH_______g。
(4)若某学生用托盘天平称量药品时,在托盘天平左盘放有20g砝码,天平达平衡时游码的位置如图,则该同学所称量药品的质量为__________________。
(5)在用98%的浓H2SO4配制2 mol/L的H2SO4溶液的实验中,以下
操作中会引起所配稀H2SO4溶液浓度偏高的是_______。
A.洗涤量取浓H2SO4后的量筒,并将洗涤液转移到容量瓶中
B.稀释后的H2SO4溶液未冷却趁热转移到容量瓶中
C.容量瓶中原有少量蒸馏水
D.定容摇匀后,发现凹液面低于刻度线,又用胶头滴管滴加蒸馏水至刻度线
E.定容时俯视
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com