
题目列表(包括答案和解析)
11.海洋是巨大的资源宝库,从海洋中可提取许多重要物质。请你参与下列探究活动并完成有关问题:
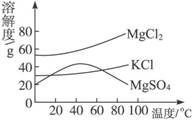
(1)我市某盐场测得:①海水含NaCl约为3.5%;(即指溶质氯化钠的质量占整个溶液中质量的百分比为3.5%,下同)②在海边打深井;③井水中含NaCl约为8%。晒盐最好选择____________(填序号)作原料,理由是________________________。
(2)关于晒盐原理的说法正确的是____________。
A.利用阳光和风力,使氯化钠蒸发出来
B.利用阳光和风力,使水分蒸发,析出食盐
C.降低温度使氯化钠析出
D.日光照晒后,氯化钠的溶解度变小
(3)晒盐后得到的母液(又称卤水)中含有氯化镁(MgCl2)、硫酸镁(MgSO4)和氯化钾(KCl)等物质。参照图中各物质的溶解度曲线,从卤水中提取氯化钾晶体可采用下列方法:
①将卤水加热到60 ℃以上蒸发水分后,会逐渐析出____________(填名称)晶体,其理由是________________________。
②将①中的晶体过滤后,得到滤液,把滤液降温至30℃以下,又析出氯化钾晶体,然后用少量的____________(填“热水”或“冷水”)洗涤这两种晶体的混合物,就可以得到较纯的氯化钾晶体。
解析:氯化钠的溶解度受温度影响变化不大,应采用蒸发水分离出晶体。根据曲线图对比几种物质溶解度曲线的不同点后再进行判断。
答案:(1)② NaCl的质量分数大,经土层过滤后污染小 (2)B
(3)①硫酸镁 温度高于60 ℃后硫酸镁的溶解度随温度升高而减小 ②冷水
10.禽流感期间,某养殖户需配制2 000 g 2%(即指溶质氢氧化钠的质量占整个溶液中质量的百分比为2%)氢氧化钠溶液以给禽舍用具进行杀菌消毒。试计算完成:
(1)配制时需称取氢氧化钠固体____________ g,水____________mL(水的密度取1 g·cm-3)。
(2)用质量为23.1 g的烧杯为容器,在托盘天平上称取所需的氢氧化钠固体时,请在下表中选出所需的砝码(打“√”表示选用),并在图中选出能正确表示游码位置的选项(填序号)____________。
|
法码大小/g |
100 |
50 |
20 |
20 |
10 |
5 |
|
打“√”表示选用 |
|
|
|
|
|
|

解析:(1)根据公式“溶质质量=溶液质量×质量分数”和“溶剂质量=溶液质量-溶质质量”进行计算;(2)根据托盘天平使用的注意事项?思考。
答案:(1)40 1 960 (2)C
|
法码大小/g |
100 |
50 |
20 |
20 |
10 |
5 |
|
打“√”表示选用 |
|
√ |
|
|
√ |
|
9.如图所示,在常温下将一个塑料小球放入盛有饱和食盐水的烧杯中,塑料小球漂浮在食盐水中。

(1)现加入少量食盐晶体,充分搅拌和静置后,在温度不变的情况下,小球在液面沉浮有何变化?____________,并简述理由:________________________。
(2)若要在不用外力的情况下使小球略上浮,你准备采取的具体方法是___________________。
解析:饱和食盐水中再加入氯化钠晶体后,晶体不溶解,所以烧杯内溶液的密度不变,小球在液面上的沉浮情况不变。要想使小球上浮,就要设法使其溶液的密度增大。
答案:(1)沉浮情况不变 因为氯化钠晶体加入到氯化钠饱和溶液中,在温度不变的情况下,不会继续溶解,溶液的密度不变,小球排开液体的体积也不变
(2)升高温度后加入氯化钠晶体,使溶液的密度增大(或加入其他可溶性固体物质,如硝酸钾,使溶液的密度增大等)
8.已知20 ℃时KNO3的溶解度为31.6 g,溶解度曲线如右图所示。

(1)20 ℃时,将25 g KNO3放入到100 g水里,搅拌,得到不饱和溶液。则该溶液中溶质的质量分数为____________。
(2)欲使其变为饱和溶液可采取的方法有:____________或____________或____________。
(3)20 ℃时,将35 g KNO3放入到100 g 水里,搅拌,得到的溶液是____________(填“饱和”或“不饱和”),该溶液中溶质的质量分数是____________。
解析:(1)依据溶质质量分数公式计算。
(2)不饱和溶液要变为饱和溶液,一般可采用:①加溶质;②蒸发溶剂;③降低温度的方法。
(3)从溶解度曲线可知,20 ℃时35 g KNO3放入到100 g水中KNO3不能全部溶解,得到饱和溶液,再用20℃时KNO3的溶解度31.6 g计算:31.6 g/(100+31.6) g×100%=24%。
答案:(1)20% (2)降低温度 蒸发溶剂 增加硝酸钾晶体 (3)饱和 24%
7.t℃时,分别向盛有10 g水的两支试管中,加入等量的甲、乙两种固体物质,使其充分溶解,可观察到如图所示的现象。


(1)t ℃时,____________(填“A”或“B”)试管中的溶液一定是饱和溶液。
(2)图中可表示甲物质的溶解度曲线的是____________(填“a”或“b”),要使A试管中剩余的固体继续溶解可采用____________或____________的方法。
解析:(1)根据饱和溶液与不饱和溶液的概念可判断A试管中的溶液一定是饱和溶液。
(2)从曲线图上可看出在t ℃时b的溶解度比a小,表示甲的是b;从曲线图上还可知b的溶解度随温度升高而增大,故溶质甲继续溶解,可采用升高温度或加水的方法。
答案:(1)A (2)b 加水 升高温度
6.A、B、C三种固体物质的溶解度曲线如图所示。据图完成下列问题:
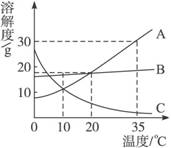
(1)升高温度,接近饱和的____________物质溶液会变得饱和。
(2)10 ℃时,三种物质溶解度大小关系为:________________________。
(3)35 ℃时,A物质的饱和溶液中:溶质、溶剂、溶液的质量比为____________。
(4)20 ℃时,25 g B物质放入到盛100 g水的烧杯中,充分溶解后溶液是(填“饱和”或“不饱和”)____________溶液。
(5)20 ℃时,取100 g A物质的饱和溶液,将温度升高到35 ℃,此时溶液中溶质的质量分数是(填“变大”“变小”或“不变”)____________。
(6)要将A从它的饱和溶液中结晶出来,最好采取____________的方法,而要将B从它的饱和溶液中大量析出,最好采取________________________的方法。
解析:要学会分析溶解度曲线图中的各种含义,能根据曲线图中的数据得出一些结论。
答案:(1)C (2)B>A=C (3)30∶100∶130 (4)饱和 (5)不变 (6)降温结晶 蒸发溶剂结晶
5.某温度下,在100 g水中加入 m g CuSO4或加入n g CuSO4·5H2O均可使溶液恰好达到饱和,则m与n的关系符合( )
A.m=160n/250 B.m=1 600n/(2 500+9n)
C.m=1 600n/(2 500+16n) D.m=1 600n/(2 500+25n)
解析:因为所得溶液均为硫酸铜的饱和溶液,在相同温度下溶质的质量分数相等,所以有:m÷(100+m)=(160n÷250)÷(100+n)。整理后即得答案是B项。本题关键是n g CuSO4·5H2O溶于水后如何确定溶质、溶剂和溶液的质量。
答案:B
4.20 ℃时,将不同质量的氯化钠固体分别放入100 g水中,充分溶解后过滤,所得溶液质量与加入氯化钠质量的对应关系如下表。其中所得溶液一定属于饱和溶液的是( )
|
|
A |
B |
C |
D |
|
加入食盐质量/g |
10 |
20 |
30 |
40 |
|
所得溶液质量/g |
110 |
120 |
130 |
136 |
解析:根据溶液质量等于溶质质量与溶剂质量之和,D组不相等,说明还有未溶解的氯化钠,所以一定属于饱和溶液。
答案:D
3.下列对“20 ℃时,硝酸钾溶解度为31.6 g”的解释正确的是( )
A.20 ℃时,31.6 g硝酸钾溶解在100 g水里
B.20 ℃时,100 g溶液中含31.6 g硝酸钾
C.31.6 g硝酸钾溶解在100 g水中达到饱和状态
D.20 ℃时,31.6 g硝酸钾溶解在100 g水中恰好达到饱和状态
解析:根据溶解度的概念包含以下四个内容:①温度一定;②溶剂一定(100 g);③饱和状态;④单位:克。D选项符合溶解度的概念。
答案:D
2.2010年6月5日世界环境日的主题为“海洋存亡,匹夫有责”。下列说法正确的是( )
A.海水是纯净物 B.海水中的溶质只有氯化钠一种
C.海水是饱和溶液 D.海水晒盐的原理是蒸发溶剂得到晶体
解析:海水中的溶质有多种,但氯化钠的含量较多,而氯化钠的溶解度受温度影响变化不大,应采用蒸发溶剂的方法得到晶体。
答案:D
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com