
题目列表(包括答案和解析)
4.勒沙特列原理是自然界一条重要的基本原理, 试运用此原理分析:氯化银在下列溶液中溶解度最少的是
A. 饱和食盐水 B. 0.1 mol/L的盐酸
C. 0.1 mol/L的CaCl2溶液 D. 新制的饱和氯水
3.向4 L容器中充入0.7 mol SO2和0.4 mol O2,4 s末测得剩余SO2是0.3 mol,则u(O2)为
A. 0.100 mol /(L·min) B. 0.025 mol /(L·s)
D. 0.050 mol /(L·min) D. 0.0125 mol /(L·s)
2.在等温、等容条件下有下列气体反应:2A(气)+2B(气) C(气)+3D(气)。现分别从两途径建立平衡:I A和B的起始浓度均为2mol/L;II C和D的起始浓度分别为2 mol/L和6mol/L。下列叙述正确的是
C(气)+3D(气)。现分别从两途径建立平衡:I A和B的起始浓度均为2mol/L;II C和D的起始浓度分别为2 mol/L和6mol/L。下列叙述正确的是
A.I和II两途径最终达到平衡时,体系内混合气体的体积分数相同
B.I和II两途径最终达到平衡时,体系内混合气体的体积分数不同
C.达平衡时,I途径的反应速率等于II途径的反应速率
D.达平衡时,I途径混合气体密度为II途径混合气体密度的1/2
1.一定温度下,向一容积为2 L的真空密闭容器中(事先装入催化剂)通入1 mol 氮气和3 mol氢气。3 min后测得容器内氮气的物质的量为0.8 mol。在此时间内, 用氢气的量的变化来表示该反应的平均速率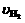 是
是
A. 0.6 mol/(L·min) B. 0.3 mol/(L·min)
C. 0.2 mol/(L·min) D. 0.1 mol/(L·min)
产物一: H2 ,用途: 合成氨及合成汽油的原料 ;
产物一: C ,用途: 橡胶工业的原料 。
2.1moL CH4与Cl2在烧瓶内发生取代反应,待反应完全后,测得四种取代物的物质的量相等,则消耗Cl2为( B )moL;生成HCl( B )moL;生成的气体总物质的量为( C )moL
A.0.5 B.2.5 C.2.75 D.4
1.光照条件下,将等物质的量的CH4与Cl2混在集气瓶中,经光照充分反应后,得到产物的物质的量最多的是( D )
A.CH3Cl B.CH2Cl2 C.CHCl3 D.HCl
此时瓶中共有几种物质( D )
A.四种 B.五种 C.六种 D.七种
5.将一定量的CH4、O2和Na2O2放在一密闭容器中,用电火花不断引燃混合气体,使其充分反应。结束后,容器内的压强趋于零,其剩余固体溶与水无气体放出。
⑴有关Na2O2反应方程式 2CH4 + O2 + 6Na2O2 =2Na2CO3 + 8NaOH
⑵求CH4、O2、Na2O2的物质的量之比为 2:1:6
4.常温下,甲烷与足量的氧气的混合气体共57mL,点燃爆炸后,剩余气体为23mL(恢复到原状态)。求原混合气体中甲烷的体积。17mL
3.一定质量的甲烷不完全燃烧得到的产物为CO,CO2和水蒸气,此时混合气体质量为49.6g,当其缓慢通过无水CaCl2时,CaCl2质量增加25.2g。原混合气体中CO2的质量为 ( C )
A.24.4g B.19.7g C.13.2g D.12.5g
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com