
题目列表(包括答案和解析)
4.经科学研究发现,元素原子最外层电子数是8或第一层为最外层且电子数为2的原子是很稳定的,而最外电子层电子数是1的元素容易失去这个电子,最外层电子数是7的原子容易得到电子,如果原子最外层电子数是4,其单质在导电方面具有某些特殊的优良性能,如硅原子最外电子层有4个电子,因而常被用作半导体材料。下列可作半导体材料的是( )

思路解析:对本题信息的处理要注意去伪存真,排除干扰。题干中给出了半导体材料原子结构的明显信息,即原子的最外层电子数是4。
答案:C
快乐时光
读小学四年级的弟弟胖得实在不像话,大家常常取笑他。
一天,老师要他们一班同学开始在联络簿上记下“每天帮家里做的事”,弟弟怎么也想不出来,最后只好由妈妈代为填写。她在联络簿上写了:“每天帮家里吃饭”。老师的评语是:“看得出来,你很努力!”
30 分钟训练(巩固类训练,可用于课后)
3.某元素R,其原子结构中M(第3)层电子数是L(第2)层电子数的3/4,则该元素的离子结构示意图是( )

思路解析:根据核外电子排布可知,该原子第三层电子数为8×(3/4)=6。应该得到2个电子。
答案:B
2.跟铵根离子(NH+4)具有相同质子数和电子数的粒子是( )
A.H2O B.LiF C.OH- D.Na+
思路解析:NH+4具有11个质子,10个电子,应该与D相同。
答案:D
1.某元素R的原子核带x个正电荷,则R2+的核外电子总数为( )
A.x-2 B.x+2 C.x D.无法确定
思路解析:原子核的电荷数减去失去的电子数2,即为该离子的电子数。
答案:A
4.质子数相同、核外电子数不同的两种粒子,它们可能是( )
A.两种不同元素的原子 B.同种元素的原子和离子
C.不同种元素的原子和离子 D.一种分子和一种离子
思路解析:两种不同元素的原子,其质子数一定不等,故A不选;同种元素的原子和离子,质子数必然相同而核外电子数一定不同,故B正确;不同种元素的原子和离子,其质子数必然不同,故C不选。一种分子和一种离子完全有可能,例如O2分子,其质子数为16,核外电子数也为16,而S2-的质子数为16,但其核外电子数为18,显然D正确。
答案:BD
10分钟训练 (强化类训练,可用于课中)
3.下列粒子结构示意图能表示原子的是_________;表示阳离子的是_________;表示阴离子的是_________。

思路解析:原子结构示意图中 ,弧线表示电子层,弧线上面的数字表示该层的电子数;当质子数=核外电子数时,为原子的结构示意图;质子数>核外电子数时,是阳离子的结构示意图;质子数<核外电子数时,是阴离子结构示意图。
,弧线表示电子层,弧线上面的数字表示该层的电子数;当质子数=核外电子数时,为原子的结构示意图;质子数>核外电子数时,是阳离子的结构示意图;质子数<核外电子数时,是阴离子结构示意图。
答案:AD B C
2.根据下列各组元素的原子结构示意图分析,具有相似化学性质的一组是( )

思路解析:元素的性质,特别是化学性质与原子的最外层电子数关系密切,最外层电子数相同,其化学性质相似,最外层电子数为8(若只有1个电子层,其电子数为2),其化学性质相对稳定。故A中两种粒子都是稳定结构,化学性质相似。C中尽管最外层的电子数都为2,但前者是稳定结构,后者易失去2个电子。
答案:A
1.按要求用正确的化学符号表示:
(1)2个氮原子____________。(2)铵根离子____________。(3)地壳中含量最多的金属元素。____________ (4)1个硫酸分子____________。(5)构成氯化钠晶体的阴离子____________。(6)由硫离子与亚铁离子构成的物质____________。
思路解析:本题考查基本化学符号及其应用。
答案:(1)2N (2)NH+4 (3)Al (4)H2SO4 (5)Cl- (6)FeS
19.推广使用含10%乙醇的汽油,目的是开发石油替代资源,改善汽车尾气排放.常温下,乙醇是一种能溶于水和汽油的液体,能在空气中燃烧.制取乙醇的方法是将淀粉水解生成葡萄糖(化学式:C6H12O6),葡萄糖在酶的作用下转化为乙醇(化学式:C2H5OH)和二氧化碳,另查资料知:纸张等含纤维素的物质也可水解生成葡萄糖.请根据上述信息回答下列问题:
(1)总结乙醇的有关知识.乙醇的物理性质有:______________________________________.乙醇的化学性质(用化学方程式表示)有:_____________________________________________.
(2)写出葡萄糖转化为乙醇的化学方程式:____________________________________________.
(3)若想利用身边的废弃物生产乙醇,你设想的生产过程是:___________________________.
答案:(1)乙醇是一种能溶于水和汽油的液体
C2H5OH+3O2 2CO2+2 H2O
2CO2+2 H2O
(2)C6H12O6 2C2H5OH+2CO2↑
2C2H5OH+2CO2↑
(3)废弃的淀粉类物质(或纤维素类物质)+葡萄糖→酒精.
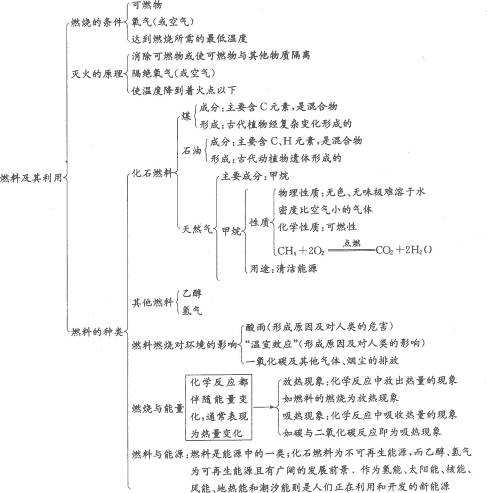
第7单元知识网络
18.甲醇是一种剧毒的、具有酒精气味的液体,现把一定质量的甲醇与4.4g氧气混合于一个密闭容器内,点燃发生如下反应:8CH3OH+xO2 mCO2+nCO+16H2O.当反应物完全转化为生成物后,降至常温常压下,容器内余下的液体为3.6g,求:
mCO2+nCO+16H2O.当反应物完全转化为生成物后,降至常温常压下,容器内余下的液体为3.6g,求:
(1)化学计量数m与n的和;
(2)反应产生CO2的质量;
(3)系数x的值.
答案:(1)8 (2)3.3 g (3)11
中考链接
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com