
题目列表(包括答案和解析)
3.将t℃时质量分数为40%的KNO3溶液100克,恒温蒸发掉20克水,析出晶体1克。
求:(1)t℃时KNO3的溶解度
(2)t℃时在100克40%的KNO3溶液中加入多少克KNO3,恰好达到饱和?
2.将W克某物质完全溶于水中,得到20℃时V毫升饱和溶液,若该溶液的密度为( )克/毫升,则此溶液溶质质量分数为__________,该湿度下的溶解度为___________.
(2)m为4.4g
(3)设矿石中CaCO3的质量为x。以第一次实验结果计算。
CaCO3+2HCl===CaCl2+H2O+CO2↑
100 44
x 1.76g
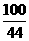 =
=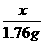 x=4g
x=4g
故矿石中碳酸钙的质量分数=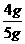 ×100%=80%
×100%=80%
例4. (2002年山西省中考题)
某样品为铜和氧化铜的混合物,为测定该样品中氧化铜的含量,取用20g此样品,分四次向其中加入稀盐酸与之充分反应。每次所用盐酸的体积与反应后剩余固体的质量见下表:
|
第次 |
加入稀盐酸的体积/mL |
剩余固体的质量/g |
|
1 |
40 |
16 |
|
2 |
40 |
12 |
|
3 |
40 |
8 |
|
4 |
40 |
8 |
试求:
(1)20g样品中铜的质量
(2)样品中氧化铜的质量分数
(3)用氢气充分还原5g此样品,可得到固体的质量。
[解析]。(1)第三、四次剩余固体均为8g,说明该剩余固体不能与盐酸反应,它一定是铜。因此20g样品中铜的质量为8g。
(2)CuO的质量分数: ×100%=60%
×100%=60%
 (3)设用氢气还原5g样品生成铜的质量为x。
(3)设用氢气还原5g样品生成铜的质量为x。
H2+CuO H2O+Cu
80 64
5g×60% x
=3g
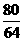 =
= x=2.4g
x=2.4g
可得固体质量:2.4g+(5g-3g)=4.4g
答:20g样品中铜的质量为8g,氧化铜的质量分数为60%,用氢气充分还原5g此样品只可得铜4.4g.
习题精练
1.已知60℃时硝酸钾的溶解度为110克,现有500克60℃的硝酸钾溶液,若蒸发掉10克水,湿度恢复到60℃不可能有的情况是( )
A.析出硝酸钾晶体的质量等于11克 B.析出硝酸钾晶体的质量小于11克
C.析出硝酸钾晶体的质量大于11克 D.没有硝酸钾晶体析出
(三)在一道计算题中若同时包含了两种或两种以上的基本计算类型,就属于综合计算,主要类型如下:
1.化学式计算与化学方程式计算的综合
2.溶解度与饱和溶液溶质的质量分数的换算
3.化学方程式计算与溶液计算的综合
其中最常邮的是第3种类型,这类计算的类型有:
(1)先根据化学方程式进行计算,将求得的有关纯物质质量作为溶质,再时行关于溶质的质量分数或溶解度的计算,若反应物彼此恰好完全反应,求反应后所得溶液溶质的质量分数时,找准溶液的质量是解题的关键,有两种方法。
质量守恒:
溶液质量=反应物质质量总和-脱离溶液的质量(气体、沉淀、析出晶体、不容杂质等)
溶液组成法:
溶液质量=溶质质量(根据方程式求算)+溶剂质量(原反应物溶液中的水+化学反应中生成的水)
一般用第一种方法计算较为简便。
(3)先根据溶质的质量分数和溶液质量算出溶质质量,再代入化学方程式进行有关计算。
综合计算涉及的概念较多,头绪繁杂,在审题时要善于化繁为简,把复杂问题分解成几个简单问题求解。同时在解题过程中要做到思路清晰、步骤完整、计算准确、格式规范,还要注意单位和精确度要求。
例1.(2002 北京市四城区中考题)
实验定有一瓶存放时间较长的氢氧化钠,其中的一部分已转化成碳酸钠,现要用该药品配制10%的氢氧化钠溶液。取50.6g该药品,溶于200mL水中,然后慢慢地滴入17.1%的氢氧化钡溶液,当用去100g氢氧化钡溶液时,碳酸钠恰好反应完全。求:
(1)50.6该药品中碳酸钠的质量。
(2)滤出沉淀后所得溶液中溶质的质量和溶液的质量。
(3)向所提溶液中再加入多少毫升水才能配制成10%的氢氧化钠溶液。
[解析]这是一道涉及到溶液和化学方程式的综合计算题。
设50.6g该药品中碳酸钠的质量为x,生成碳酸钡和氢氧钠的质量分别为y和z.
(1)Ba(OH)2的质量=100g×17.1%=17.1g
Na2CO3+Ba(OH)2===BaCO3↓+2NaOH
106 171 197 80
x 17.1g y z
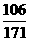 =
= x=10.6g
x=10.6g
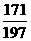 =
=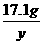 y=19.7g
y=19.7g
 =
=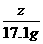 z=8g
z=8g
(2)NaOH溶液中溶质的质量为:
50.6g-10.6g+8g=48g
NaOH溶液的质量为:
50.6g+200mL×1g/mL+100g-19.7g=300.9g
(3)需加入水的体积为:
(48g÷10%-330.9g)÷1g/mL=149.1mL
答:略
例2.(2002年 福建省泉州市中考题)
工业上常用废铜屑跟热的稀硫酸和氧气反应制取硫酸铜:
2Cu+O2+2H2SO4===2CuSO4+2H2O 现将25.6吨废铜屑和368吨热的稀硫酸混合,通入足量的氧气,恰好完全反应。试计算:
(1)参加反应的氧气有多少吨?
(2)可制得我水硫酸铜多少吨?
(3)反应后溶液中CuSO4的质量分数是多少?
[解析] 尽管这个化学反应是新遇到的,但是所涉及的计算步骤和方法应该是熟悉的。
 设参加反应的O2的质量为x,生成的CuSO4质量为y.
设参加反应的O2的质量为x,生成的CuSO4质量为y.
2Cu + O2+2H2SO4 2CuSO4+2H2O
2×64 32 2×160
25.6T x y
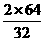 =
= x=6.4T
x=6.4T
 =
= y=64T
y=64T
CuSO4的质量分数=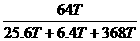 ×100%=16%
×100%=16%
答:参加反应的O2有6.4T;可制得无水硫酸铜的64T;CuSO4溶液中溶南的质量分数为16%。
例3.(2002年,安徽省中考题)
石灰石是我省的主要矿产之一。学校研究性学习小组为了测定当地矿山石灰石中碳酸钙的质量分数,取来了一些矿石样品,并取稀盐酸200g。平均生成4份,进行实验,结果如下:
|
实验 |
1 |
2 |
3 |
4 |
|
加入样品的质量/g |
5 |
10 |
15 |
20 |
|
生成CO2的质量/g |
1.76 |
3.52 |
4.4 |
m |
(1)哪几次反应中矿石有剩余?_______________________________________。
(2)上表中m的数值是_______________________________。
(3)试计算这种石灰石矿中碳酸钙的质量分数。
[解析] 要善于分的所给的实验数据,并能透过现象看本质。将稀盐酸分成4分,每份为50g。
第一次加入5g样品生成1.76gCO2,而第二次加入10g样品,生成CO2的质量为1.76g×2=3.52g,第三次加入15g样品,生成CO2的质量为4.4g≠1.76g×3,说明从第三次开始,样品均过量。即产生CO2的量决定于盐酸的量。由此可见:
(二)溶质质量人数与溶解度的比较
|
溶质质量分数 |
溶解度 |
|
表示溶液的浓稀 |
表示溶质溶解性的大小 |
|
不受湿度的影响 |
受湿度的影响 |
|
不一定是饱和溶液 |
一定是饱和溶液 |
|
单位是一,省略不写 |
单位是克 |
(一)溶液计算知识结构
 定义 一种或几种物质分散到另一种物质里,形成均一的、稳定的混合物
定义 一种或几种物质分散到另一种物质里,形成均一的、稳定的混合物
溶质 被溶解的物质.
组成
溶剂 溶解其它物质的物质。
饱和溶液与不饱和溶液
浓溶液与稀溶液(溶质质量分数的高低)
溶解度的定义 略
内因 溶质、溶剂的性质
影响溶解度的因素(固体)
外因 湿度 压强(对气体而言)
(1)大多数物质“陡升型”如KNO3
固体溶解度随湿度变化情况 (2)少数物质“缓升型”如NaCl
(3)极少数物质“下降型”如Ca(OH)2
一定湿度下饱和溶液中溶质、溶剂、溶液的质量比
一定湿度下饱和溶液中溶质、溶剂、溶解度的相互换算
溶解度(克)= ×100(克)
×100(克)
溶质的质量分数= ×100%
×100%
溶质质量分数(a%)与体积(V)、密度(ρ)的有关计算
溶液质量m液=V·ρ
溶质质量m液=V·ρ·a%
溶解度(S)与饱和溶液溶质质量分数的换算
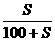 ×100%=a%
×100%=a%
4.能对溶液、化学方程式等计算进行综合运用。
3.通过联系实际和实验的有关计算,体会溶质质量分数计算的意义。
2.能够正确分析溶液加水稀释或加溶质变浓过程进行有关溶质质量分数变化的计算。培养分析和计算能力。
§4-3有关溶液的计算 §4-4综合计算
1.准确理解溶质质量分数及密度的概念,能够根据它们与溶质质量、溶剂质量、溶液质量和溶液体积之间的关系,时行有关换算,培养综合计算能力。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com