
题目列表(包括答案和解析)
3.用氯化钠固体配制质量分数为5%的氯化钠溶液的主要步骤:(1)______________________;(2)_______________________;(3)_______________________.
答案:(1)计算 (2)称量食盐 量取水 (3)溶解(将水与食盐混合,搅拌)
2.氯化钠溶液的质量分数为10%,这表示每100g____________中含有10g____________和90g________________________.
答案:氯化钠溶液 氯化钠 水
1.溶质的质量分数是____________和____________之比,溶液中溶质的质量分数用计算式表示为________________________.
答案:溶质质量 溶液质量 (溶质质量/溶液质量)×100%
20.(2005,南京)为了测定蜡烛中碳、氢两种元素的质量比,某化学兴趣小组设计了如图10-4所示的实验.
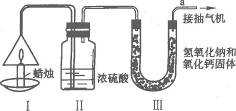
图10-4
实验步骤如下:先分别称量蜡烛、装置Ⅱ、装置Ⅲ的质量.按图示连接好仪器装置,点燃蜡烛,同时从a导管口抽气,一段时间后熄灭蜡烛,再分别称量蜡烛、装置Ⅱ、装置Ⅲ的质量.实验数据如表10-3.
表10-3
|
|
蜡烛 |
装置Ⅱ |
装置Ⅲ |
|
反应前的质量/g |
15.8 |
182.3 |
212.2 |
|
反应后的质量/g |
14.4 |
184.1 |
216.6 |
(1)该实验中测得水的质量为____________g,二氧化碳的质量为____________g.
(2)由该实验数据计算,蜡烛中碳、氢元素的质量之比为____________,(相对原子质量:H-l;C-12;O-16) .
(3)装置Ⅱ和装置Ⅲ的顺序能否颠倒?____________(填“能”或“不能”).
(4)理论上,装置Ⅱ和装置Ⅲ增加的总质量大于蜡烛失去的质量,其原因是_________________________________.
(5)该实验能否准确测出蜡烛燃烧生成二氧化碳和水的质量?____________(填“能”或“不能”),理由是____________________________________.
答案:(1)1.8 4.4 (2)6;1 (3)不能 (4)与消耗的蜡烛比较,生成的二氧化碳和水的质量包含参加反应的氧气所含氧元素的质量 (5)不能,空气中的水也被装置Ⅱ、Ⅲ吸收
19.(2005,河南)在学习NaOH的性质时,老师将CO2通入盛有NaOH溶液的试管中,同学们没有观察到明显现象.CO2和NaOH发生反应了吗?探究活动从这个疑问开始.
(1)明明同学认为两者发生了反应,他设计了一种方案,如图10-3所示,加入适量NaOH溶液后,他可观察到小气球的变化是____________________;产生这种现象的原因是________________________;写出反应的化学方程式_________________.
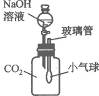
图10-3
(2)另一位同学认为这个方案还不足以证明CO2和NaOH确实发生了反应,因为NaOH溶
液中有水,二氧化碳又能溶于水.为使实验方案更完善,你认为还需要做的实验是__________.
答案:(1)气球胀大 CO2和NaOH反应使瓶内气压减小 CO2+2NaOH==== Na2CO3+ H2O
(2)在反应后的溶液中滴入Ba(OH)2溶液[或Ca(OH)2溶液],或在反应后的溶液中滴入稀盐酸,或取两个同样的试剂瓶充满CO2后,注入同体积的水和NaOH溶液,比较气球胀大的程度等.
18.某一气体混合物中含有CO2、CO和N2四种气体.现将其分别通过如下试剂(均足量),请判断所得气体的组成情况(假设每步反应都进行完全).
(1)依次通过NaOH溶液、浓H2SO4,最后得到的气体有_________________(填化学式);写出发生反应的化学方程式__________________.
(2)依次通过灼热的CuO粉末、浓H2SO4,最后得到的气体有______________(填化学式);写出发生反应中生成物的化学式_____________________________.
(3)依次通过灼热的CuO粉末、NaOH溶液、浓H2SO4,最后得到的气体有________________(填化学式).
答案:(1)CO、N2 CO2+2NaOH====Na2CO3+ H2O
(2)CO2、N2 CO2、Cu
(3)N2
17.某校化学兴趣小组为测定空气中二氧化硫的含量,用NaOH溶液吸收SO2,反应方程式如下:2NaOH+SO2====Na2SO3+ H2O
用NaOH溶液吸收1000L已除去CO2的空气样品,溶液质量增重了0.64g,已知此时空气的密度约为1.3g/L,求:
(1)被吸收的SO2质量.
(2)发生反应的NaOH的质量.
(3)空气中SO2的质量分数(计算结果精确到0.01%) .
解:(1)溶液质量增重了0.64g,即被吸收的SO2质量.
(2)设发生反应的NaOH的质量为x,则:
2NaOH+SO2====Na2SO3+ H2O
80 64
x 0.64 g
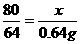
x=0.8 g
(3)空气中SO2的质量分数=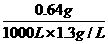 ×100%=0.05%
×100%=0.05%
答:(1)被吸收的SO2质量为0.64 6.(2)发生反应的NaOH的质量为0.8g.(3)空气中SO2的质量分数为0.05%.
中考链接
16.某同学设计了如下一组实验.取四朵用石蕊试液染成的紫色的干燥纸花,分别按图10-2进行实验.回答下列问题:
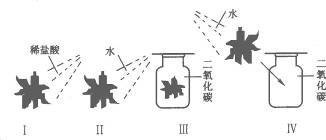
图10-2
(1)观察到纸花的颜色变化是;Ⅰ.纸花变红;Ⅱ._______________;Ⅲ.纸花不变色;Ⅳ._______________.
(2)该同学进行的Ⅰ、Ⅱ两项实验,说明什么?
(3)该同学进行四组对比实验的目的是什么?(用文字叙述)______________________________.
(4)写出实验Ⅳ中发生反应的化学方程式:___________________________________________.
答案:(1)纸花不变色 纸花变红 (2)稀盐酸能使紫色石蕊变红,水不能使紫色石蕊变红 (3)证明二氧化碳和水不能使紫色石蕊变红,酸能使紫色石蕊变红,二氧化碳溶于水生成酸 (4)CO2+ H2O=H2CO3
15.著名化学家罗伯特·波义尔(RobertBoyle)在一次实验中,不小心将盐酸溅到紫罗兰花瓣上,过一会儿,他惊奇地发现,紫色的花瓣上出现了红点点.波义尔对这一意外的发现,做出了各种假设,经过多次实验验证,探究普遍规律,终于获得了成功.对紫罗兰花瓣遇盐酸变红的现象,你有哪些假设?请将你的各种假设以及验证假设的实验方案填写在表10-2中.
表10-2
|
你对紫罗兰花瓣遇盐酸变红现象的各种假设 |
你验证假设的实验方案 |
|
|
|
答案:如表D10-2所示.
表D10-2
|
你对紫罗兰花瓣遇盐酸变红现象的各种假设 |
你验证假设的实验方案 |
|
1.其他酸也能使花瓣变红吗? 2.碱溶液也能使花瓣变色吗? 3.酸能使其他的花瓣变色吗? |
1.将稀硫酸、稀硝酸等滴到花瓣上,观察现象 2.将氢氧化钠等溶液滴到花瓣上,观察现象 3.用其他的花瓣做实验,观察现象 |
14.如图10-1所示,装置中a为弹簧夹,b为分液漏斗的活塞(通过开、关活塞可以随时滴加液体)先关闭b,打开a,将混有少量CO和CO2气体由左侧导管通入,充分反应后,排出的气体主要是_____________;然后关闭a,打开b,一段时间后排出的气体主要是__________________________.
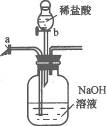
图10-1
答案:CO CO2
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com