
题目列表(包括答案和解析)
15.(1999年全国,14)氢镍电池是近年开发出来的可充电电池,它可以取代会产生镉污染的镉镍电池。氢镍电池的总反应式是 H2+NiO(OH)
H2+NiO(OH) Ni(OH)2。根据此反应式判断,下列叙述中正确的是( )
Ni(OH)2。根据此反应式判断,下列叙述中正确的是( )
A.电池放电时,电池负极周围溶液的pH不断增大 B.电池放电时,镍元素被氧化
C.电池充电时,氢元素被还原 D.电池放电时,H2是负极
解析:放电时,H2做原电池负极被氧化为H+,其周围的pH减小。充电时,H2做电解池的阴极,氢被还原为H2。
14.(1998年全国,22)将质量分数为0.052(5.2%)的NaOH溶液1 L(密度为1.06 g·cm-3)用铂电极电解,当溶液中NaOH的质量分数改变了0.010(1.0%)时停止电解,则此时溶液中应符合的关系是( )
|
|
NaOH的质量分数 |
阳极析出物的质量/g |
阴极析出物的质量/g |
|
A |
0.062(6.2%) |
19 |
152 |
|
B |
0.062(6.2%) |
152 |
19 |
|
C |
0.042(4.2%) |
1.2 |
9.4 |
|
D |
0.042(4.2%) |
9.4 |
1.2 |
解析:电解NaOH溶液时电极反应为:
阳极:4OH--4e-====2H2O+O2↑
阴极:4H++4e-====2H2↑,即电解水。
由此可知电解后NaOH浓度增大,阳极产物(O2)质量大于阴极产物(H2)质量。
13.(1998年全国,10)下列关于铜电极的叙述正确的是( )
A.铜锌原电池中铜是正极 B.用电解法精炼粗铜时粗铜作阴极
C.在镀件上电镀铜时可用金属铜作阳极 D.电解稀硫酸制H2、O2时铜作阳极
解析:由于二者都是一元的,故可完全反应生成强碱弱酸盐MA,A-水解显碱性,故C正确;溶液呈电中性,故D正确。
12.(1998年上海,31)氯碱厂电解饱和食盐水制取NaOH的工艺流程示意图
14-4如下
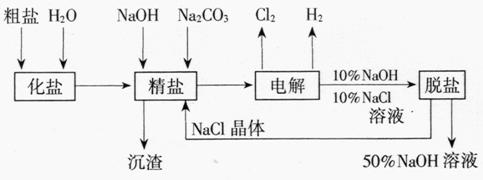
图14-4
依据上图,完成下列填空:
(1)在电解过程中,与电源正极相连的电极上所发生反应的化学方程式为 ,与电源负极相连的电极附近,溶液pH (选填“不变”“升高”或“下降”)。
(2)工业食盐含Ca2+、Mg2+等杂质。精制过程发生反应的离子方程式为
、 。
(3)如果粗盐中SO2-4含量较高,必须添加钡试剂除去SO ,该钡试剂可以
,该钡试剂可以
是 (选填a,b,c多选扣分)。
a.Ba(OH)2 b.Ba(NO3)2 c.BaCl2
(4)为有效除去Ca2+、Mg2+、SO ,加入试剂的合理顺序为
(选填a、b、c多选扣分)。
,加入试剂的合理顺序为
(选填a、b、c多选扣分)。
a.先加NaOH,后加Na2CO3,再加钡试剂
b.先加NaOH,后加钡试剂,再加Na2CO3
c.先加钡试剂,后加NaOH,再加Na2CO3
(5)脱盐工序中利用NaOH和NaCl在溶解度上的差异,通过 、冷却、 (填写操作名称)除去NaCl
(6)在隔膜法电解食盐水时,电解槽分隔为阳极区和阴极区,防止Cl2与NaOH反应;采用无隔膜电解冷的食盐水时,Cl2与NaOH充分接触,产物仅是NaClO和H2,相应的化学方程式为 。
解析:(1)与电源负极相连的电极,其反应为:2H++2e-===H2↑,促使H2O===H++
OH-向右移动,产生大量OH-,pH升高。
(3)溶液中已有OH-、Cl-,如果加入Ba(NO3)2,即掺入了新的杂质NO-3离子。
(4)欲有效除去三种离子,所加的三种试剂应过量,过量的Ba2+必须用CO2-3除去,所以加钡试剂必须在加Na2CO3之前。
答案:(1)2Cl--2e-====Cl2;升高
(2)Ca2++CO =====CaCO3↓
=====CaCO3↓
Mg2++2OH-====Mg(OH)2↓
(3)a、c (4)b、c (5)蒸发;过滤
(6)NaCl+H2O=====NaClO+H2↑
或2NaCl+2H2O=======H2↑+Cl2↑+2NaOH
Cl2+2NaOH====NaCl+NaClO+H2O
11.(1998年上海,10)以下现象与电化腐蚀无关的是( )
A.黄铜(铜锌合金)制作的铜锣不易产生铜绿
B.生铁比软铁芯(几乎是纯铁)容易生锈
C.铁质器件附有铜质配件,在接触处易生铁锈
D.银制奖牌久置后表面变暗
解析:本题主要要求考生掌握形成原电池的条件、正负极的判断等知识。答案:D
10.(1997年全国,5)钢铁发生吸氧腐蚀时,正极上发生的电极反应是( )
A.2H++2e-====H2 B.Fe2++2e-====Fe
C.2H2O+O2+4e-====4OH- D.Fe3++e-====Fe2+
答案:C
9.(1996年全国,21)实验室用铅蓄电池作电源电解饱和食盐水制取氯气,已知铅蓄电池放电时发生如下反应:负极Pb+SO ====PbSO4+2e-,正极PbO2+4H++SO
====PbSO4+2e-,正极PbO2+4H++SO +2e-====PbSO4+2H2O今若制得Cl2 0.050mol,这时电池内消耗的H2SO4的物质的量至少是( )
+2e-====PbSO4+2H2O今若制得Cl2 0.050mol,这时电池内消耗的H2SO4的物质的量至少是( )
A.0.025 mol B.0.050 mol C.0.10 mol D.0.20 mol
解析:该题只要明确原电池和电解池原理,抓住转移电子守恒即可。由2Cl--2e-=Cl2,可知制0.05 mol Cl2转移0.10 mol电子,再由铅蓄电池总反应:
Pb+PbO2+4H++2SO ======2PbSO4+2H2O 可看出每转移2 mol e-消耗2 mol H2SO4,现转移0.10 mol电子,将耗0.10 mol硫酸。
======2PbSO4+2H2O 可看出每转移2 mol e-消耗2 mol H2SO4,现转移0.10 mol电子,将耗0.10 mol硫酸。
8.(1995年全国,17)将分别盛有熔融的氯化钾、氯化镁、氧化铝的三个电解槽串联,在一定条件下通电一段时间后,析出钾、镁、铝的物质的量之比为( )
A.1∶2∶3 B.3∶2∶1 C.6∶3∶1 D.6∶3∶2
解析:三个电解槽通过的电子数相等,设都通过6 mol电子(此为参照数法),则析出金属钾、镁、铝的物质的量分别为6 mol、3 mol、2 mol,所以比为6∶3∶2。
8.(1995年上海,27)G、Q、X、Y、Z均为氯的含氧化合物,我们不了解它们的化学式,但知道它们在一定条件下具有如下的转换关系(未配平):
(1)G Q+NaCl
(2)Q+H2O
Q+NaCl
(2)Q+H2O X+H2
X+H2
(3)Y+NaOH G+Q+H2O (4)Z+NaOH
G+Q+H2O (4)Z+NaOH Q+X+H2O
Q+X+H2O
这五种化合物中氯的化合价由低到高的顺序为( )
A.QGZYX B.GYQZX C.GYZQX D.ZXGYQ
解析:此题要求掌握①歧化反应原理即由中间价生成相对较高价态和较低的价态,由此可知(3)中Y的价态介于Q、G之间;由(4)知Z的化合价介于Q、X之间;②Q+H2O X+H2,其中H2由2H+
X+H2,其中H2由2H+ H2得之,而X则一定由Q失电子化合价升高得之,即化合价X>Q,联系(4)可知Q<Z<X;由(1)NaCl中Cl-为氯的最低价,可知Q价>G价,联系(3)可知G<Y<Q,故选C。
H2得之,而X则一定由Q失电子化合价升高得之,即化合价X>Q,联系(4)可知Q<Z<X;由(1)NaCl中Cl-为氯的最低价,可知Q价>G价,联系(3)可知G<Y<Q,故选C。
8.(1994年全国,22)银锌电池广泛用作各种电子仪器的电源,它的充电和放电
过程可以表示为2Ag+Zn(OH)2 Ag2O+Zn+H2O,在此电池放电时,负极上发生反应的物质是( )
Ag2O+Zn+H2O,在此电池放电时,负极上发生反应的物质是( )
A.Ag B.Zn(OH)2 C.Ag2O D.Zn
解析:根据方程式,放电时反应为:
?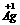 2O+
2O+ +H2O 2
+H2O 2 +
+ (OH)2原电池中失去电子的物质是负极,所以选D。
(OH)2原电池中失去电子的物质是负极,所以选D。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com