
题目列表(包括答案和解析)
26.(2003春季理综,9). 家用炒菜铁锅用水清洗放置后,出现红棕色的锈斑,在此变化过程中不发生的化学反应是( )
A. 
B. 
C. 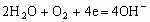
D. 
答案. D
25.(2002广东,10).在原电池和电解池的电极上所发生的反应,同属氧化反应或同属还原反应的是
A 原电池的正极和电解池的阳极所发生的反应
B 原电池的正极和电解池的阴极所发生的反应
C 原电池的负极和电解池的阳极所发生的反应
D 原电池的负极和电解池的阴极所发生的反应
答案BC
24.(2002上海化学, 16).某学生想制作一种家用环保型消毒液发生器,用石墨作电极电解饱和氯化钠溶液,通电时,为使Cl2被完全吸收,制得有较强杀菌能力的消毒液,设计了如图的装置,则对电源电极名称和消毒液的主要成分判断正确的是
16).某学生想制作一种家用环保型消毒液发生器,用石墨作电极电解饱和氯化钠溶液,通电时,为使Cl2被完全吸收,制得有较强杀菌能力的消毒液,设计了如图的装置,则对电源电极名称和消毒液的主要成分判断正确的是
(A) a为正极,b为负极;NaClO和NaCl
(B) a为负极,b为正极;NaClO和NaCl
(C) a为阳极,b为阴极;HClO和NaCl
(D) a为阴极,b为阳极;HClO和NaCl
答案.B
22.(2001年全国,2)下列过程中不涉及化学变化的是 ( )
A.甘油加水作护肤剂
B.用明矾净化水
C.烹鱼时加入少量的料酒和食醋可减少腥味,增加香味
D.烧菜用过的铁锅,经放置常出现红棕色斑迹
解析:物质的变化过程有两个方面。一是化学变化,二是物理变化。有新物质生成的变化才是化学变化。明矾净水的原因是铝离子水解生成了Al(OH)3胶体,Al(OH)3胶体微粒具有吸附性,可吸附水中杂质而净水。烹鱼时料酒和食醋反应生成了醋,增加了香味。铁锅生锈是因为发生了电化学腐蚀。只有甘油溶于水的过程为物理过程。
23(2002春季理综,12).通以相等的电量,分别电解等浓度的硝酸银和硝酸亚汞(亚汞的化合价为+1)溶液,若被还原的硝酸银和硝酸亚汞的物质的量之比n(硝酸银)∶n(硝酸亚汞)=2∶1,则下列表述正确的是
A 在两个阴极上得到的银和汞的物质的量之比n(硝酸银)∶n(硝酸亚汞)=2∶1
B 在两个阳极上得到的产物的物质的量不相等
C 硝酸亚汞的分子式为HgNO3
D 硝酸亚汞的分子式为Hg2(NO3)2
答案D
21.(2001年上海,7)铜片和锌片用导线连接后插入稀硫酸中,锌片是( )
A.阴极 B.正极 C.阳极 D.负极
解析:电解池的两极分别命名为阴阳极,原电池的两极分别命名为正负极。铜片和锌片用导线连接后插入稀硫酸中形成了原电池,其中锌失电子作原电池的负极。
20.(2000年春,24)用两支惰性电极插入500 mL AgNO3溶液中,通电电解。当电解液的pH从6.0变为3.0时(设电解时阴极没有氢气析出,且电解液在电解前后体积变化可以忽略),电极上析出银的质量大约是( )
A.27 mg B.54 mg C.108 mg D.216 mg
解析:在阳极水电离出的OH-放电,破坏了水的电离平衡,H+浓度增大。由题意知:n(H+)=0.5 L×(10-3-10-6)mol·L-1=5×10-4 mol,阴阳两极放电数目相等,阴极析出的银的物质的量等于阳极析出氢气的物质的量,m(Ag)=5×10-4mol×108 g·mol-1×103=54 mg。
19.(2000年全国,18)下列关于实验现象的描述不正确的是( )
A.把铜片和铁片紧靠在一起浸入稀硫酸中,铜片表面出现气泡
B.用锌片做阳极,铁片做阴极,电解氯化锌溶液,铁片表面出现一层锌
C.把铜片插入三氯化铁溶液中,在铜片表面出现一层铁
D.把锌粒放入盛有盐酸的试管中,加入几滴氯化铜溶液,气泡放出速率加快
解析:铜铁是两种活泼性不同的金属,稀硫酸是电解质溶液,三者共同形成原电池,铁片上发生氧化反应;Fe-2e-====Fe2+,铜片上发生还原反应:2H++2e-====2H 2H====H2↑故A选项正确。B选项中的条件相当于在铁片上镀锌即电镀池,锌片上发生的反应为:Zn-2e-====Zn2+,铁片上发生的反应为:Zn2++2e-====Zn,理论上ZnCl2溶液的浓度不变,故B选项也正确。
Cu+2FeCl3=2FeCl2+CuCl2,故C选项错误。Zn+2HCl====ZnCl2+H2↑,向其中加入几滴氯化铜溶液后,发生反应Zn+Cu2+====Zn2++Cu,则铜和锌及电解质溶液形成了原电池,发生原电池反应,加快了氢气的放出速率,故D选项也正确。
18.(2000年春,14)100 mL浓度为2 mol·L-1的盐酸跟过量的锌片反应,为加快反应速率,又不影响生成氢气的总量,可采用的方法是( )
A.加入适量的6 mol·L-1的盐酸 B.加入数滴氯化铜溶液
C.加入适量蒸馏水 D.加入适量的氯化钠溶液
解析:向溶液中再加入盐酸,增加了H+的物质的量,也就增加了放出的H2的量,故A错;因锌是过量的,放出H2的量取决于盐酸的量,加入CuCl2后,有少量铜析出,附在锌片上,形成了原电池反应,反应的速率加快,故B正确;向原溶液中加入水或氯化钠溶液都引起溶液中H+浓度的下降,反应速率变慢,故C、D都不对。
17.(2000年上海,8)随着人们生活质量的不断提高,废电池必须进行集中处理的问题被提到议事日程,其首要原因是( )
A.利用电池外壳的金属材料
B.防止电池中汞、镉和铅等重金属离子对土壤和水源的污染
C.不使电池中渗泄的电解液腐蚀其他物品
D.回收其中石墨电极
解析:随着生产的发展和人们生活水平的提高,环境污染和环保问题已越受到人们重视,废电池中含有汞等多种重金属离子,极易对环境造成污染。答案:B
16.(1999年全国,24)用惰性电极电解M(NO3)x的水溶液,当阴极上增重a g时,在阳极上同时产生b L氧气(标准状况),从而可知M的相对原子质量是( )
A. 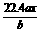 B.
B.
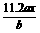 C.
C. 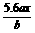 D.
D.
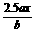
解析:阴阳两极转移电子的数目相同:



湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com