
题目列表(包括答案和解析)
3.在合成氨工业中,为增加NH3的日产量,实施下列过程中与平衡移动无关的是
A.不断将氨分离出来 B.使用催化剂
C.采用450℃左右的高温 D.采用2×107-5×107Pa的压强
2.下列萃取与分液结合进行的操作(用CCl4为萃取剂从碘水中萃取碘)中错误的是
A.饱和碘水和CCl4加入分液漏斗中后,塞上上口部的塞子,用一手压住分液漏斗上口部,一手握住活塞部分,把分液漏斗倒转过来振荡
B.静置,待分液漏斗中溶液分层后,先使分液漏斗内外空气相通(准备放出液体)
C.打开分液漏斗的活塞,使全部下层液体沿承接液体的烧杯内壁慢慢流出
D.最后继续打开活塞,另用容器承接并保存上层液体
1、环境问题关系到人类的生存和发展,保护环境就是保护人类自己。从保护环境的角度出发,目前最有发展前景的一次性餐具是
A.瓷器餐具 B.塑料餐具
C.淀粉餐具 D.不锈钢餐具
27、(16分)(1) NaOH、Na2CO3 3∶1 33.6 (5分) (2)Na2CO3、NaHCO3 (2分) 1∶1 (2分) 112(1分)
(3)
解:图示表明,向溶液中滴加0.1mol/L的盐酸至不再放出CO2气体时,消耗盐酸的体积为75mL。(2分)
所以原NaOH溶液的物质的量浓度为:
 (4分)
(4分)
26、(15分)
(1)从图中可知,60mL Ba(OH)2溶液恰好中和10mL混酸。(1分)则:
[H+]×10 = (0.025×2)×60,解得:[H+]
= 0.3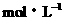 (2分)
(2分)
设[H2SO4]为C1,[HCl]为C2,从图中可知,20mL Ba(OH)2恰好跟H2SO4完全反应,则:0.025×20 = C1×10,解得C1 = 0.05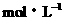 ,C2 = 0.3-0.05×2 = 0.2
,C2 = 0.3-0.05×2 = 0.2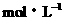 。(4分)
。(4分)
(2)A点:因为20mL Ba(OH)2正好将混酸中H2SO4中和完全,所以混酸中只有HCl。(1分)则[H+] = 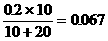
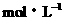 (2分),pH = -lg6.7
(2分),pH = -lg6.7 10-2 = 1.17。(1分)B点:混酸中的HCl被加入的(40-20)mL Ba(OH)2溶液中和了一部分,(1分)
10-2 = 1.17。(1分)B点:混酸中的HCl被加入的(40-20)mL Ba(OH)2溶液中和了一部分,(1分)
则[H+]
= 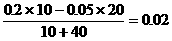
 (2分), pH = -lg2
(2分), pH = -lg2 10-2 = 1.7。(1分)
10-2 = 1.7。(1分)
25、(17分)
(1)玻璃棒;容量瓶;胶头滴管(2)24.8 (4)淀粉(3+2+2分)
(5)设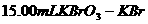 混合液遇酸反应后生成
混合液遇酸反应后生成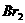 的物质的量为
的物质的量为
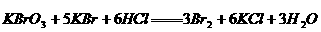 (1分)
(1分)
1 3
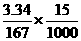 x
x 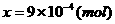 (2分)
(2分)
设过量的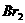 的物质的量为
的物质的量为 ,由
,由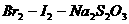
知: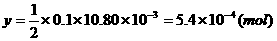 (2分)
(2分)
则与苯酚反应的溴的物质的量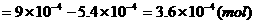 (1分)
(1分)
设100mL废水中苯酚的物质的量为zmol
由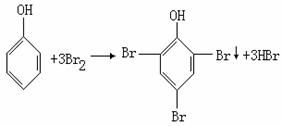 (1分)
(1分)
知: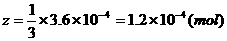 (1分)
(1分)
废水中苯酚的含量为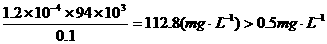
可知,超过国家标准,不能排放。(2分)
24、(2+2+2+4分)(1)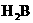 (2)
(2) 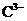 ,
,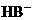 (3)BC
(3)BC
(4)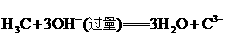
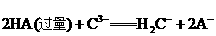
23、(6分)取少量CH3COOH溶液,滴加石蕊试液,溶液呈红色,然后向其中加入CH3COONH4晶体、振荡,可看到红色变浅,说明CH3COOH中存在电离平衡,既CH3COOH为弱酸。(3分)(2)取少量CH3COONa 晶体溶于水,滴加酚酞试液,溶液呈红色,即CH3COO― 水解,破坏了水的电离平衡,说明CH3COOH是弱酸。(3分)
22、(6分)乙同学的解释是正确的。可利用CH3COONH4进行实验证明。(2分)
由已知电离度知,CH3COONH4溶于水后,CH3COO-与NH4+水解程度相同,CH3COONH4溶于水本身不会改变pH大小。但在CH3COOH溶液中加入CH3COONH4后,其电离出的CH3COO-对CH3COOH的电离过程的抑制作用与CH3COONa电离出的CH3COO-作用相同,即可以使CH3COOH的电离平衡向左移动,[H+]减小,pH增大。(4分)
21、(21分)每格1.5分
(1)V1≠0,V2=0:成分: NaOH ,物质的量 MV1
(2) V1=0,V2≠0成分: NaHCO3 ,物质的量 MV2
(3) V1= V2≠0成分: Na2CO3 ,物质的量 MV1
(4) V1> V2>0成分: NaOH Na2CO3 ,物质的量 M(V1-V2) MV2
(5) V2> V1>0成分: Na2CO3 NaHCO3 ,物质的量 MV1 M(V2-V1)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com