
题目列表(包括答案和解析)
7.有以下四组物质:
①FeCl2、Al(NO3)3、MgSO4、NH4NO3四种溶液
②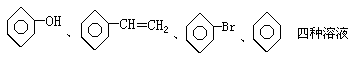 ③MnO2、FeS、CuO、C四种黑色固体
④NaCl、AlCl3、Ba(OH)2、HCl四种溶液。其中只用一种试剂(允许加热)就能将组内物质区别开的是( )
A.只有①③ B.只有①②③
C.只有①③④ D.全部
③MnO2、FeS、CuO、C四种黑色固体
④NaCl、AlCl3、Ba(OH)2、HCl四种溶液。其中只用一种试剂(允许加热)就能将组内物质区别开的是( )
A.只有①③ B.只有①②③
C.只有①③④ D.全部
6.某工厂排放的酸性废液里含有游离氯。Cl2可氧化Na2SO3,要除去游离氯并中和其酸性,正确的方法是 A.先加适量的Na2SO3溶液,再加适量Na2CO3溶液 B.先加适量的Na2CO3溶液,再加适量Na2SO3溶液 C.先加过量的Na2SO3溶液,再加适量Na2CO3溶液 D.先加过量的Na2CO3溶液,再加适量Na2SO3溶液
5.将淀粉溶液和淀粉酶的混合物放入玻璃纸袋中,扎好袋口,浸入流动的温水中,经相当一段时后,取袋内液体分别与碘水、新制Cu(OH)2悬浊液(加热)、浓硝酸(微热)作用,其现象依次是
|
试剂 |
A |
B |
C |
D |
|
碘水 |
显蓝色 |
显蓝色 |
无明显现象 |
无明显现象 |
|
新制Cu(OH)2(加热) |
无红色沉淀 |
红色沉淀 |
无红色沉淀 |
红色沉淀 |
|
浓硝酸(微热) |
显黄色 |
无明显现象 |
显黄色 |
无明显现象 |
4.在化学实验室进行下列实验操作时,其操作或记录的数据正确的是( ) A.用托盘天平称取8.84g食盐 B.用250mL的容量瓶配制所需的220mL、0.1mol/L的NaOH溶液 C.用量筒量取12.12mL的盐酸 D.用0.12mol/L盐酸滴定未知浓度的NaOH溶液,消耗盐酸21.40mL
3.下列各实验现象能用同一原理解释的是( ) A.苯酚、乙烯都能使溴水褪色 B.稀硫酸中加入铜粉不反应,再加硝酸钠或硫酸铁后,铜粉溶解 C.葡萄糖和福尔马林与新制氢氧化铜悬浊液共热,都产生红色沉淀 D.将SO2通入氯化钡溶液至饱和,再加入足量硝酸或苛性钠溶液,都产生白色沉淀
2.下列实验操作中,仪器需插入液面下的有①制备Fe(OH)2,用胶头滴管将NaOH溶液滴入FeSO4溶液中;②制备氢气,简易装置中长颈漏斗的下端管口;③分馏石油时,测量温度所用的温度计;④用乙醇制乙烯时所用的温度计;⑤用水吸收氨气时的导气管;⑥向试管中的BaCl2溶液中滴加稀硫酸 A.③⑤⑥ B.③⑤ C.①②④ D.①②③④⑤⑥
21、六价的铬有剧毒[b21] ,所以要对含Cr(Ⅵ)(括号内罗马数字表示元素的价态,下同)废水进行化学处理,最常见的是铁氧磁体法,即把FeSO4·7H2O加入含Cr(Ⅵ)的废水中,在pH<4时,Fe2+还原Cr(Ⅵ)为Cr(Ⅲ)。调节溶液pH达8-10,使溶液中的Fe(Ⅱ)、Fe(Ⅲ)、Cr(Ⅲ)析出组成相当于FeⅡ[Fe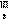 ·Cr
·Cr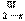 ]O4(磁性材料铁氧体的组成)沉淀。试回答:
]O4(磁性材料铁氧体的组成)沉淀。试回答:
(1)若废水中,六价铬以Cr2O72-存在。试写出在酸性条件下硫酸亚铁还原Cr2O72-的离子方程式: 。
(2)由(1)的结果可确定铁氧磁体中x= 。
(3)据(2)的结果,若废水中Cr(Ⅵ)按CrO3计,则加入的FeSO4·7H2O与CrO3的质量比应为多少才能除去废水的Cr(Ⅵ),m(FeSO4·7H2O)/m(CrO3)= 。
[b1]A
[b2]C
[b3]D
[b4]B
[b5]D
[b6]A
[b7]AB
[b8]D
[b9]C
[b10]BD
[b11]A
[b12]B
[b13]CD
[b14]AD
[b15]B
[b16]A
[b17]得到 ;还原; 失去; 氧化; 2Fe+3Cl22FeCl3;+3;Fe+2HCl====FeCl2+H2↑;+2?;强
[b18]氮和硫;碳;KNO3和硫;碳 ;CO2 ;K2S和NO2 。
[b19]还原性;氧化性;还原;氧化;CO2+4Fe2++5H2O=CH2O+3Fe2O3+8H+
[b20](1)是;MnO2;浓盐酸;4H++2Cl-+MnO2Cl2↑+Mn2++2H2O;
(2)除去氯气中混有的HCl气体 (3)浓氢氧化钠(浓碱)
(4)浓盐酸的物质的量浓度是:
被氧化的HCl的物质的量为:(5.6L/22.4L·mol-1)×2=0.5mol (提示:由化学反应方程式可知,氯气是氧化产物,1mol氯气生成,则有2mol的HCl被氧化)。
[b21](1)Cr2O72- +14H+ +6Fe2+ =2Cr3+ +6Fe3+ +7H2O (2) 1.5;(3)13.9
20.实验室中所用[b20] 少量氯气是用下列方法制取的,
4HCl(浓)+MnO2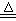 Cl2↑+MnCl2+2H2O
Cl2↑+MnCl2+2H2O
试回答下列问题:
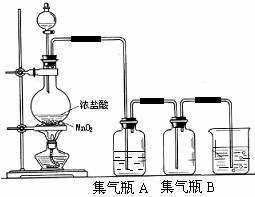
(1)该反应是氧化还原反应吗? ,如果是氧化还原反应,请指出 是氧化剂, 是还原剂,写出该反应的离子方程式 。
(2)集气瓶A中盛装的是饱和食盐水(注:氯气在饱和食盐水中溶解度很小,而氯化氢在饱和食盐水中的溶解度则很大),其作用是 。
(3)氯气溶入水显酸性,且氯气有毒,并有剧烈的刺激性,若吸入大量氯气,可中毒死亡,所以氯气尾气直接排入大气中,会污染环境。实验室中可采用 溶液来吸收有毒的氯气。
(4)一次实验中,用浓盐酸80mL,其密度为1.19g·cm-3、HCl的质量分数为36.5%,跟MnO2恰好完全反应,产生了5.6L(STP)的氯气。试计算浓盐酸的物质的量浓度和被氧化的HCl的物质的量。
18.火药是中国[b18] 的“四大发明”之一,永远值得炎黄子孙骄傲,也永远会激励着我们去奋发图强。黑火药在发生爆炸时,发生如下的反应:2KNO3+C+S===K2S+2NO2↑+CO2↑。其中被还原的元素是 ,被氧化的元素是 ,氧化剂是 ,还原剂是 ,氧化产物是 ,还原产物是 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com