
题目列表(包括答案和解析)
3、本质:反应过程有 或 。
2、特征(判别方法): 。
1、概念:凡有 的化学反应就是氧化还原反应。
26.(10分)材料M由X、Y两种元素组成,已知M的化学组成为XY8,X为碱金属元素。为进一步确定其成分,先取一定量的M在足量的纯氧中充分灼烧,产生了无色略带酸味的气体A和过氧化物B(此条件下不考虑A与B反应),且A能使澄清石灰水变浑浊。另取1.17gB加入水中能完全溶解,再将其定容为500mL,取出25.00mL加入锥形瓶中,用0.1150mol/L盐酸滴定,当滴入10.00mL盐酸时,经测定溶液的pH=12。
(1)通过计算和推理确定组成:A是 (填化学式,下同),B是
M是
(2)若取xgM(甲、乙两种元素化合价均为0),加热使其完全溶于浓硝酸,假定浓硝酸还原产物只有NO和NO2且两者的物质的量相同,试通过计算求出反应中消耗硝酸的物质的量y与材料M的质量x的函数关系表达式。
2005/2006学年度盐城市高三第-次调研考试
25. (8分)在20L恒容的密闭容器中,加入3mo1SO3(g)和lmo1氧气,在一定温度下使其反应,反应至4min时,氧气的浓度为0.06mol/L,当反应到8min时,反应到达平衡,此时三氧化硫浓度c(SO3)=amol/L。
(8分)在20L恒容的密闭容器中,加入3mo1SO3(g)和lmo1氧气,在一定温度下使其反应,反应至4min时,氧气的浓度为0.06mol/L,当反应到8min时,反应到达平衡,此时三氧化硫浓度c(SO3)=amol/L。
(1)0min-4min内生成O2平均速率v(O2)= mol/L·min
(2)达到平衡时c(O2)=c(SO2),则a= mol/L,在下列
坐标系中作出0min-8min及之后SO2、O2、SO3浓度
随时间变化曲线.
(3)若起始时按下表数据投料,相同温度下达到平衡时,三氧化硫浓度大于a mol/L的是
|
|
A |
B |
C |
D |
|
SO3 |
1mol |
3mol |
3mol |
0mol |
|
SO2 |
2mol |
1.5mol |
0mol |
6mol |
|
O2 |
2mol |
1mol |
0mol |
5mol |
24.(8分)2005年诺贝尔化学奖由法国科学家YvesChauvin、美国科学家RobertH.Orubbs、 RichardR.Schrock共同获得。以表彰他们在烯烃复分解反应方面研究与应用所作出的贡献。已知烯烃的交叉复分解反应机理为双键断裂,换位连接。可表示为:
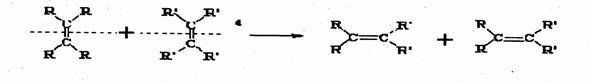
|
 又已知:R-CH2-CH=CH2+Cl2
R-CH Cl –CH=CH2+HCl
又已知:R-CH2-CH=CH2+Cl2
R-CH Cl –CH=CH2+HCl
有机物R是烃的含氧衍生物(分子式为:C9H14O6),常用作纤维的增塑剂以及化妆晶等,F也可由油脂水解得到,有机物R的合成路线如下:
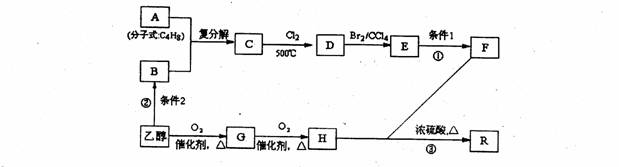 试回答下列问题
试回答下列问题
(1)写出反应①、②的反应条件:条件1 ;条件2 。
(2)写出结构简式,A: ;E: 。
(3)写出反应③的化学方程式: 。
23.(10分)试完成(1)、(2)两小题。
(1)今有相对分子质量为M的有机物,燃烧后只生成二氧化碳和水。
①若有机物是M=72的烃,请写出所有可能的结构简式: ; ; ; ②若M=58,且lmol该有机物与足量的银氨溶液作用,可析出4molAg,则其结构简式 为 ;
③若A是分子式为C12H16的烃,B是含4个氧原子的烃的含氧衍生物,A、B相对分子质量相等,则B的分子式可能为: 。
(2),奥美拉唑(Omepraz01e)是基于2005年诺贝尔医学奖成果研制的药物,该药物对幽门螺旋杆菌引起的胃及十二指肠溃疡根治率最高。·奥美拉唑的合成路线如下(Me表示甲基)
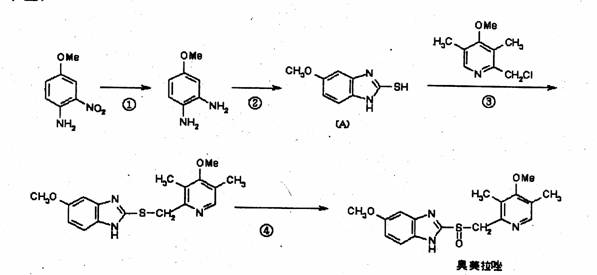
试回答下列
(a)写出反应类型① 反应,③ 反应,④ 反应。
(b)反应②是与一种无机小分子反应(在氢氧化钾作用下),一分子与一分子反应时脱去一分子硫化氢得到(A)的,这种无机小分子化学式为:
(c)为使最终产品尽量少含杂质,反应过程中不产生污染物,你认为反应④中选用一种理想的无机试剂应是 (填化学式)。
22.(1.0分)已知C、D、F、I均为常见气体,E为常见金属,G溶液蒸干并灼热得红棕色粉末H,I是一种能导致温室效应的气体,B由三种元素组成三它们有如下框图关系:
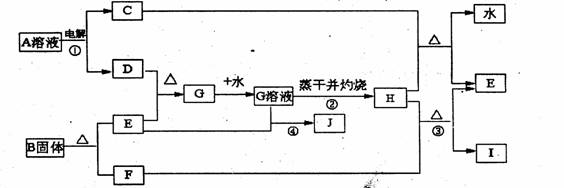
试回答下列问题
(1)反应①阳极的电极反应式 。
(2)反应③的化学方程式 。
(3)反应④的审子方程式 。
(4)反应②蒸发至于并灼烧最终得H而不是无水的G,试用文字和方程式简述其理由:
。
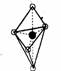 (5)已知B的结构为三角双锥(如右图示),图中○代表F分子,●代表E原子,
(5)已知B的结构为三角双锥(如右图示),图中○代表F分子,●代表E原子,
写出B的化学式 。
21.(8分)无机过氧化合物的科学研究开始于18世纪初,人们相继制得了过氧化钡、过氧化钠、过氧化钾、过氧化氢等,目前无机过氧化合物逐渐成为无机化学的一个分支,其中过氧化氢是用途最广的过氧化物。试回答下列问题。
(1)Na2O2、K2O2、CaO2以及BaO2都可与酸作用生成过氧化氢,目前实验室制取过氧化氢可通过上述某种过氧化物与适量稀硫酸作用,过滤即可制得。最适合的过氧化物是 (写电子式)
(2)过氧化氢是一种绿色氧化剂,写出在酸性条件下H2O2氧化氯化亚铁的离子反应方程 式: 。
(3)与过氧化氢具有相同电子总数且属于非极性性分子的有 、 (举两例, 写化学式)。
(4)纯的过氧化氢常用作火箭燃料的氧化剂,已知0.4m01液态肼(N2H4)与足量的液态过氧化氢反应,生成N2和H2O(g),放出256.6kJ的热量。.则该反应的热化学方程式为
20.(12分)亚硝酰氯(C1NO)是有机合成中的重要试剂,可由NO与C12在通常条件下反应得到, 另外硝酰氯可由二氧化氮与氯气作用得到。某研究性学习小组拟在通风橱中制取亚硝酰氯,先查得其如下资料:
|
英文名称 |
nitrosylchloride nitrogenoxychloride |
别名 |
氯化亚硝酰;氧氯化氮 |
|||
|
分子式 |
C1NO |
外观与性状 |
红褐色液体或黄色气体,具有刺鼻恶臭味,遇水和潮气分解成氮的氧化物和氯化氢。 |
|||
|
熔点 |
-64.5℃沸点:-5.5℃ |
溶解性 |
溶于浓硫酸 |
|||
|
危险标记 |
有毒气体,有机剧毒品 |
主要用途 |
用于合成清洁剂、触媒及中间体 |
|||
后他们拟定了如下合成装置示意图:
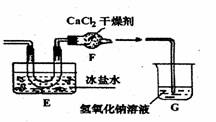
|
|
|
|


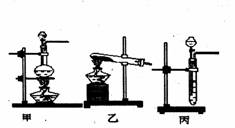
试回答下列问题:
(1)制备NO最好选用的装置是 (选填:甲、乙、丙,下同),制备C12应选用
的装置是 。
(2)实验室制取氯气的化学方程式为 。
(3)无水氯化钙的作用是: 。
(4)写出亚硝酰氯水解的化学方程式: 。
(5)指导老师认为装置G不能有效除去有毒气体,写出你的见解和改进措施。
。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com