
题目列表(包括答案和解析)
29.(15分)某研究性学习小组拟用铜屑与氧化铜混合物与硫酸和硝酸组成的混酸反应来制取CuSO4·5H2O晶体,混酸中硝酸的还原产物为NO,反应过程中不产生SO2,反应后的溶液中不含Cu(NO3)2, 反应中固体完全溶解,两种酸均恰好完全反应。设固体混合物的总质量为480 g,其中铜的质量分数为x,试回答下列。
(1)所得硫酸铜晶体的质量y为: g(用x表示)。
(2)若x =0.4,混酸中HNO3与H2SO4的物质的量之比为: 。
(3)若x=0.4,480g固体混合物与一定量混酸微热后,充分反应,冷却恰好只得到CuSO4·5H2O,试求原混酸中H2SO4的质量分数为 。
塘栖中学2006届高三理科综合训练题(六)
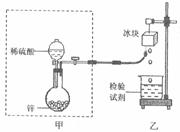
28.(15分)I、用如右图所示装置进行实验,将A中液体加入到B中,
在甲装置内制备某种气体,在乙装置对甲中产生的气体进行性质实验。
(1)图中D仪器在实验中的作用是 ,
若要检查甲装置的气密性,具体的操作步骤为
.
(2)若A中为浓盐酸:①若B中盛有某种紫黑色固体,c中盛有KI淀粉溶液,旋开F、E后,C中的溶液变蓝色,则B中固体为 ;继续通气体于C中,足够长的时间后,发现C中溶液蓝色褪去,这是因为在溶液中的I2被氧化为HIO3,写出此反应的化学方程式
。
②若B中盛有某种无色液体,当C中盛石蕊试液时,旋开F、E后,C中的溶液变红色,当C中盛品红溶液时,旋开F、E后,品红溶液不褪色,则B中无色液体为
。C中盛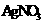 溶液时,写出C中反应的化学方程式
.
溶液时,写出C中反应的化学方程式
.
|
|
 (1)甲同学从下列试剂中选择了一种检验
(1)甲同学从下列试剂中选择了一种检验
试剂,成功检测到了H2O2的存在,该试剂是
A.淀粉溶液 B.氯化钠溶液
C.氢氧化钠溶液 D.淀粉碘化钾酸性溶液
甲同学检验时证明H2O2产生的实验现象是 。
反应的离子方程式为 。
(2)乙同学用较稀的酸性高锰酸钾溶液作为检验试剂,实验时观察到高锰酸钾溶液褪色(生成Mn2+),由此也证明了氢气燃烧有H2O2,写出该反应的离子方程式
。
(3)丙同学对乙同学的检验方案提出质疑:若锌粒中杂质与稀硫酸反应有少量H2S、SO2,等气体生成,也会使高锰酸钾溶液褪色,从而导致错误的判断。为消除丙同学的疑虑,请你提出对上述实验装置的改进建议。 。
27.(15分)2003年11月《环球时报》美国特约记者文章:一种名为苹果醋(ACV)的浓缩饮料多年来风靡美国。ACV是一种由苹果发酵而成的酸性饮品,是具有明显药效的健康食品,有解毒、降脂、减肥和止泻功能。苹果酸是这种饮料的主要酸性物质,分离提纯后的化学分析如下:(1)元素分析证明该酸只含C、H、O三种元素,其中C、H、O的质量比为24:3:40;该酸蒸气的密度是同温同压下氢气密度的67倍。(2)0.1mol该酸与足量NaHCO3,反应放出4.48LCO2,与足量金属钠反应放出3.36L H2(气体体积均已折算为标准状况下的体积)。请回答下列问题:
(1)该酸的分子式为 ,结构简式为 。
(2)写出该酸在Cu/Ag催化条件下,被氧气氧化的反应化学方程式
。
(3)写出该酸在一定条件下,每两个分子发生分子间脱水生成环酯的所有结构简式:
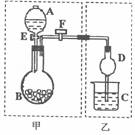 。
。
26.(15分)A、B、C、D、E五种短周期元素的原子序数依次增大,且知:
①其原子半径的大小关系是:D>E>B>C>A;
②A、D同主族,并可形成离子晶体DA;
③B、D、E三者的最高价氧化物对应的水化物两两之间均可反应生成可溶性盐和水,且所得盐中均含C元素;
④B、E两种元素原子的最外层电子数之和等于A、C、D三种元素原子的最外层电子数之和。
请填写下列空白:
(1)DA与水反应后所得溶液的pH 7(填“>”、“<”或“=”)。
(2)化合物D2C2的电子式为 ,化合物BA3所属晶体类型为 。
(3)1mol E单质与足量的D的最高价氧化物的水化物溶液反应,能产生 mol A2气体。
(4)化合物BA3与BC在加热和有催化剂存在的条件下能发生反应,生成两种无毒物质,则该反应的化学方程式为 。
13、下列实验操作中,错误的是( )
A.配制5%食盐溶液时,将称量的食盐放在烧杯中加适量的蒸馏水搅拌溶解
B.硫酸铜结晶水含量测定时,需用小火缓慢加热,防止晶体飞溅
C.配制氯化铁溶液时,将一定量的氯化铁溶解在较浓的盐酸中,再用水稀释到所需浓度
D.用pH试纸测得新制氯水的pH为2
12.醋酸可以通过分子间氢键双聚。一定温度下,将一定质量的冰醋酸加水稀释过程中,溶液的导电能力变化如右下图所示,有关说法不正确的是( )
A、在 b处溶液导电能力最强,但此时醋酸并未完全电离
B、用湿润的pH试纸测量c处溶液的pH值,比实际pH值偏大
C、若在a、b、c三点向该溶液中加入1mol/L氢氧化钠溶液,恰好中和时,消耗氢氧化钠溶液体积:a>b>c
D、若在“O”点醋酸双聚成八元环分子,则其结构为:
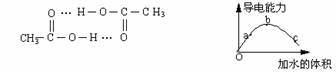
11.分析下图所示的四个原电池装置,结论正确的是( )
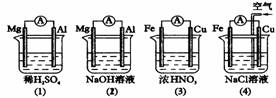
A.(1)(2)中Mg作负极,(3)(4)中Fe作负极
B.(2)中Mg作正极,电极反应式为: 6 H2O +6e-=6OH-+3 H2↑
C.(3)中Fe作负极,电极反应式为: Fe一2e-=Fe2+
D.(4)中Cu作正极,电极反应式为: 2H++2e-=H2↑
10.某溶液中仅含有Na+、H+、OH-、CH3COO-四种离子,下列说法不正确是( )
A、在上述溶液中加入少量的NaOH或HCl溶液时,溶液的pH有可能不会发生显著变化
B、溶液中四种离子之间不可能满足:c(CH3COO-)>c(Na+)>c(OH-)>c(H+)
C、当溶液中溶质为CH3COONa和NaOH时,则一定有 c(Na+)>c(OH-)>c(CH3COO-)>c(H+)
D、当四种离子之间能满足c(CH3COO-)>c(Na+)> c(H+)> c(OH-)时,则溶液中溶质一定是CH3COONa和CH3COOH
9. 在一恒定的容器中充入2 mol A和1 mol B发生反应:2A(g)+B(g) x
C(g),达到平衡后,C的体积分数为W%;若维持容器的容积和温度不变,按起始物质的量A:0.6 mol、B:0.3 mol、C:1.4 mol充入容器,达到平衡后,C的体积分数仍为W%,则x值为( )
在一恒定的容器中充入2 mol A和1 mol B发生反应:2A(g)+B(g) x
C(g),达到平衡后,C的体积分数为W%;若维持容器的容积和温度不变,按起始物质的量A:0.6 mol、B:0.3 mol、C:1.4 mol充入容器,达到平衡后,C的体积分数仍为W%,则x值为( )
A.只能为2 B.只能为3
C.可能是2,也可能是3 D.无法确定
8.中学化学教材中有大量数据,下列为某同学利用教材中的数据所做的判断,其中不正确的
是( )
A.用溶解度数据,可判断煮沸Mg(HCO3)2溶液所得产物是Mg(OH)2还是MgCO3
B.用沸点数据,可推测能否将一些液体混合物用分馏的方法分离开来的可能性
C.用反应热数据的大小,可判断不同反应的反应速率的快慢
D.用原子半径数据,可推断某些原子氧化性或还原性的强弱
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com