
题目列表(包括答案和解析)
28.(16分,每空2分)
(1)Zn+2H+=Zn2++H2↑…………………………………………………………2分
(2)制H2装置后缺少除HCl气体的装置;制CaH2装置后缺少干燥装置……各2分
(3)C、B………………………………………………………………………………2分
(4)通氢气;检验氢气纯度至达标;点燃尾气(或外接气体等)………………各2分
(5)CaH2+2H2O=Ca(OH)2+2H2↑……………………………………………………2分
27.(共16分,每空2分)
(1)H2;FeCl2……各2分

(3)b;Fe-2e-=Fe2+……各2分
(4)2Na2O2+2H2O=4NaOH+O2↑……2分
FeCl3+3NaOH=Fe(OH)3↓+3NaCl……2分
(5)Na2O2具有氧化性,且与水反应生成碱,故Fe2+在此条件下可被氧化生成Fe(OH)3…2分
26.(16分,每空2分)
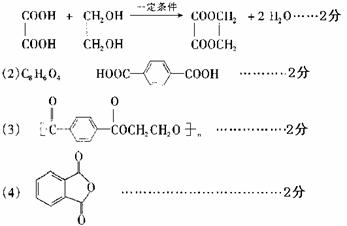 (1)C2H6O2 HOCH2CH2OH……各2分
(1)C2H6O2 HOCH2CH2OH……各2分
(5)5H2C2O4+2MnO4-+6H+=10CO2↑+2Mn2++8H2O……2分
29.(15分)有机物A只含C、H、O三种元素,其相对分子质量为62,A经催化氧化生成D,D经催化氧化生成E,A与E在一定条件下反应可生成一种环状化合物F。 则A的分子式为 ,结构简式为 ;A与E反应生成F的化学方程式为 。
(2)对有机物B的组成、结构、性质进行观察、分析,得实验结果如下:
①B为无色晶体,微溶于水,易溶于Na2CO3溶液;
②完全燃烧166mg有机物B,得到352mgCO2和54mgH2O;
③核磁共振氢谱显示B分子中只有2种不同结构位置的氢原子;
④B的相对分子质量在100~200之间。
B的分子式为 ,结构简式为 。
(3)A与B在一定条件下反应可生成一种常见合成纤维,该高分子化合物的结构简式为
。
(4)B的一种同分异构体(与B具有相同的官能团),在一定条件下可发生分子内脱水生成一种既含有五元环又有六元环的有机物G,G的结构简式为 。
(5)E可将酸性高锰酸钾溶液还原,所得还原产物为Mn2+,该反应的离子方程式为
。
塘栖中学2006届高三理科综合训练题(四)
28.(15分)锡为第IVA族元素,锡的单质和化合物与某些物质的化学性质上有许多相似之处。
(1)锡溶于盐酸,再向反应后的溶液中通入氯气,有关反应类似于铁的相应变化,试写出有关反应的化学方程式: 。
(2)将(1)中溶液蒸干后继续加热所得固体,变化过程类似于FeCl3溶液相应的变化,则最后得到的固体物质是(写分子式) 。
(3)若向(1)中所得溶液中加入适量的NaOH溶液,产生白色沉淀(该沉淀物的分子中含2个氢原子),再加过量的NaOH溶液,白色沉淀溶解。上述反应类似于AlCl3溶液的相应反应,试写出有关反应的离子方程式: 。
(4)已知锡元素具有如下性质:①Sn4++Sn====2Sn2+;②2Sn2++O2+4H+====2Sn4++2H2O;
③2H++SnO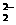
 Sn(OH)2
Sn(OH)2 Sn2++2OH-,试回答:用SnCl2固体配制并保存SnCl2溶液的方法是
,若可用SnCl2溶液与过量的碱溶液反应的方法制Sn(OH)2,该碱是
。
Sn2++2OH-,试回答:用SnCl2固体配制并保存SnCl2溶液的方法是
,若可用SnCl2溶液与过量的碱溶液反应的方法制Sn(OH)2,该碱是
。
27.(15)已知:碱金属或碱土金属(ⅡA)与H2在隔绝空气加热时可以发生反应,生成离子型金属氢化物,如NaH、CaH2等,它们易与水反应。现有甲、乙两位同学分别设计了制备CaH2的实验,装置如图所示(分别以序号I、II表示),铁架台等夹持固定仪器已略去。
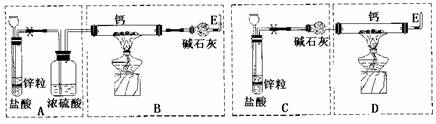
请回答下列问题
(1)锌与盐酸反应的离子方程式为 ;
(2)最后实验结果显示,两位同学的实验装置设计都有缺陷。
装置I的不足之处是 ,
装置II的不足之处是 ;
(3)请你从两套装置中选取你认为合理的部分,按从左到右的顺序组装一套制取CaH2的合理装置(用序号A、B、C……表示) ;
(4)检查完装置的气密性后,为了保证产品的纯度和实验安全必须先
,然后再 ,才能点燃酒精灯加热。同样,为了安全,反应开始后,在E口处应 ;
(5)军事和气象野外作业常用CaH2做生氢剂,使之与水反应产生H2,其反应的化学方程式为 。
26.(15分)下列图所示反应有直接进行的,也有在溶液中进行的,其中部分产物已略去。已知:A是固体单质;B、X、H为气体单质;D属于可溶于水的强电解质,一个D分子中含有18个电子。
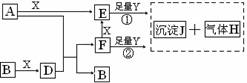
(1)化学式:B为 ,F为 。
(2)用电子式表示D的形成过程为 。
(3)A是一种非常重要的工业产品。据统计,地球上每年由于腐蚀而消耗的A约占A年产量的10%。A发生腐蚀的主要原因是(填写下面的选项序号) ;
a.直接与氧气发生化学腐蚀 b.通过原电池反应发生腐蚀 c.因溶于水而消耗掉
若你选定选项a或c,请写出相应的化学方程式;若你选定选项b,请写出负极的电极反应式: 。
(4)已知H的密度比空气的密度大,则①中所涉及的反应的化学方程式为
。
(5)写出F与足量Y反应生成J的理由:
。
13.某温度下,将a gMgSO4·7H2O溶于b g水得到饱和溶液(密度为d g·cm-3),下列说法正确的是( )
A.该温度下,MgSO4的溶解度为12000a/(126a+246b) g
B.该温度下,MgSO4的饱和溶液中,MgSO4的质量分数为a/(a+b)
C.该温度下,MgSO4的饱和溶液中,c(Mg2+)=ad/[246(a+b)]mol·L-1
D.向足量该饱和溶液中加入1.2g MgSO4,将析出2.46 g MgSO4·7H2O晶体
12.下列除去杂质的实验方法正确的是( )
A.除去CO中少量O2:通过灼热的Cu网后收集气体
B.除去K2CO3中少量Na HCO3:置于坩埚中加热
C.除去苯中溶有的少量苯酚:加入稍过量的浓溴水反应后过滤
D.除去Fe C13 酸性溶液酸中少量Fe C12:加入稍过量的双氧水反应后放置
11. T℃时,在1L密闭容器中A气体与B气体反应生成C气体。反应过程中A、B、C浓度变化如图I所示;若保持其他条件不变,温度分别为Tl和T2时,B的体积百分含量与时间的关系如图Ⅱ所示。则下列结论正确的是( )
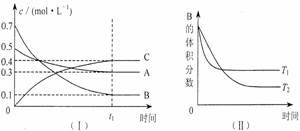
A.在达平衡后,保持其他条件不变,增大压强,平衡向逆反应方向移动
B.在达平衡后,保持压强不变,通入稀有气体,平衡向正反应方向移动
C.保持其他条件不变,若反应开始时A、B、C的浓度分别为0.4mo1·L-1、0.5 mo1·L-1和0.2 mo1·L-1,则达到平衡后,C的浓度大于0.4 mo1·L-1
D.保持其他条件不变,升高温度,正、逆反应速率均增大,且A的转化率增大
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com