
题目列表(包括答案和解析)
27.(15分)图中A-J分别代表一种反应物或生成物,已知A受热分解得到等物质的量的B、C、D气态物质,图中部分生成物未列出
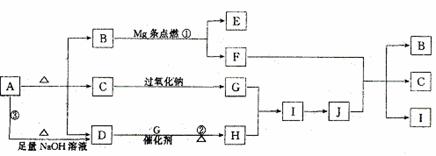
请回答
(1)B的电子式________,C是__ ___(极性、非极性)分子,D分子的空间构型为__ __。
(2)写出反应①、②的化学方程式
①______________________________________;②_______ ____________________
(3)写出反应③的离子方程式______________________________________________
26.(15分)甲、乙、丙、丁分别代表中学化学中常见的物质。根据要求回答下列问题。
(1)甲的化学式为RClx。
① 若甲为某短周期金属元素的氯化物,甲中含有的金属元素的原子半径在同周期金属元素中最小,其阳离子与氖原子有相同的电子层结构。则甲中含有的金属元素是____________;
② 若甲为某金属元素的棕色氯化物,将该氯化物水溶液加热蒸干并灼烧,得到的氧化物为红棕色粉末,则甲的化学式为________________,甲中含有的金属元素在周期表中的位置为___________________;
③ 将上述两种金属中活泼性强的金属与另一种金属的最高价氧化物混合,引燃后可发生剧烈反应,其化学方程式为_________________________________,引燃该反应的实验操作是___________________________________________。
(2)若甲、乙、丙、丁为单质或化合物,均含有某短周期中的同一种元素,常温下甲为气体,将甲通入常温下的KOH溶液中得到乙和丙,丙的水溶液具有强氧化性。
① 电解乙溶液得到甲,该反应的化学方程式为____________________________;
② 在一定条件下1 mol甲与2 mol KOH在溶液中反应得到乙和丁,n(乙) :n(丁)
=5:1,该反应的离子方程式为_____________________________________。
8、要求设计实验证明,某种盐的水解是吸热的,有四位学生分别作出如下回答,其中正确的( )
A.丁学生:在醋酸钠溶液中滴入酚酞试液,加热后若红色加深,说明盐类水解是吸热的
B.甲学生:将硝酸铵晶体溶于水,若水温下降,说明硝酸铵水解是吸热的
C.乙学生:在盐酸中加入相同温度的氨水,若实验过程中混和液温度下降,说明盐类
水解是吸热的
D.丙学生:在醋酸钠溶液中加入醋酸钠晶体,若溶液温度下降,说明盐类水解是吸热的
7、用电解质溶液为氢氧化钾水溶液的氢氧燃料电池电解饱和硫酸钠溶液一段时间,假设电解时温度不变且用惰性电极,下列说法不正确的是( )
A.当电池负极消耗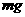 气体时,电解池阴极有
气体时,电解池阴极有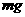 气体生成
气体生成
B.电解池的阳极反应式为:4OH--4e-==2H2O+O2↑
C.电解后,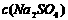 不变,且溶液中有晶体析出
不变,且溶液中有晶体析出
D.电池中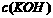 不变;电解池中溶液
不变;电解池中溶液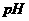 变大
变大
6、可逆反应N2+3H2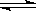 2NH3是一个放热反应。有甲、乙两个完全相同的容器,向甲容器中加入1molN2和3 molH2,在一定条件下,达平衡时放出的热量为Q1;在相同条件下,向乙容器加入2 molNH3,达平衡时,吸收的热量为Q2。已知Q2=4Q1,则甲容器中,H2的转化率为( )
2NH3是一个放热反应。有甲、乙两个完全相同的容器,向甲容器中加入1molN2和3 molH2,在一定条件下,达平衡时放出的热量为Q1;在相同条件下,向乙容器加入2 molNH3,达平衡时,吸收的热量为Q2。已知Q2=4Q1,则甲容器中,H2的转化率为( )
A.20% B.25% C.75% D.80%
5、常温下,有甲、乙两份体积均为1 L,浓度均为0.1 mol·L-1的氨水,其pH为11。甲用蒸馏水稀释100倍后,溶液的pH将为a;乙与等体积、浓度为0.2mol·L-1的HCl混合,在混合溶液中:n(NH4+)+n(H+)-n(OH-)=b mol 。a、b正确的答案组合是( )
A.9-11之间;0.1 B.9-11之间;0.2 C.12-13之间;0.2 D.13;0.1
4、羟胺(NH2OH)是一种还原剂,能将某些氧化剂还原。现用25.00mL0.049mol/L的羟胺的酸性溶液跟足量的硫酸铁溶液在煮沸条件下反应,生成的Fe2+恰好与24.65mL 0.020mol/L的KMnO4酸性溶液完全作用(已知:FeSO4+ KMnO4+ H2SO4= Fe2(SO4)3+ K2SO4+ MnSO4+ H2O(未配平),则在上述反应中,羟胺的氧化产物是( )
A.N2 B. N2O C.NO D.NO2
3、食物中碲的一个来源是装食物的含锡罐头。通常开罐时约有8毫克金属屑落入食物中,其中含碲0.1%(即8微克)。因此,用塑料包装代替罐头可以防止摄入碲,碲具有内在的毒性,碲可能会包含在酶体系中,与蛋白配合,引起肾和肝退化。碲在元素周期表中的位置是( )
A.第四周期IVA族 B.第五周期IVA族 C.第四周期VIA族 D.第五周期VIA族
2、不具有放射性的同位素称之为稳定同位素,近20年来,稳定同位素分析法在植物生理 学、生态学和环境科学研究中获得广泛应用。如在陆地生态系统研究中,2H、13C、15N、18O、34S等常用做环境分析指示物。下列说法中正确的是( )
A.34S原子核内的中子数为16 B.1H216O在相同条件下比1H218O更易蒸发
C.13C和15N原子核内的质子数相差2 D.2H+的酸性比1H+的酸性更强
1、近年来,科学家正在探索利用铝粉作为新能源的可能性,以期铝能成为一种石油的取代物。假如铝作为一种普遍使用的新型能源被开发利用,关于其有利因素的下列说法,你认为哪项是错误的 ( )
A.铝质轻,便于运输、贮存,且安全
B.铝燃烧时放出的热量大,且燃烧后新产物对环境的污染容易得到有效的控制
C.在地球上,铝矿资源比较丰富
D.现代电冶铝的工业技术已为铝作为新能源奠定了重要基础
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com