
题目列表(包括答案和解析)
6.Ⅰ.某化学课外活动小组,临时需要少量CuO,拟用硫酸铜进行制备,设计实验步骤如下:
①称量CuSO4·5H2O m1g,在研钵中研细后,完全溶于适量水中;
②向盛硫酸铜溶液的烧杯内加入稍过量的NaOH溶液,使Cu2+完全沉淀;
③将烧杯内的悬浊液转移到蒸发皿中,小火加热至沸,搅拌,直到沉淀完全变为黑色.
④冷却后,过滤。并用蒸馏水洗涤沉淀2-3次;
⑤将固体充分干燥后,称量得CuO m2g,研细备用。
请回答:
(1)本实验多次用到玻璃棒,其作用分别为步骤①__________,步骤③________,步骤④___________。
(2)步骤②中证明NaOH已足量的方法是____________________。
(3)步骤④中洗涤沉淀的操作为______________,目的是__________________
Ⅱ.该小组又用氨气还原氧化铜的方法测定铜的近似相对原子质量,反应的化学方程式为:2NH3+3CuO N2+3Cu+3H2O请回答:
N2+3Cu+3H2O请回答:
(1) 如果选用测定生成物Cu和H2O的质量m(Cu)、m(H2O)时,请用下列仪器设计一个简单的实验方案。
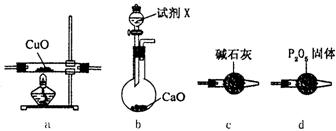
①仪器连接的顺序(用字母编号表示,仪器可重复使用)________________;d的作用是_____________;b中试剂X的名称是____________。
②列出计算Cu的相对原子质量的表达式___________________________。
(2)①如果仍采用上述仪器装置,测定下列物理量也可以达到实验目的的有____________,
A.m(CuO)和m(H2O) B.V(N2)和m(CuO)
C.m(NH3)和m(H2O) D.m(CuO)和m(Cu)
②若可以增加仪器装置,为达到实验目的,上述A、B、C、D还可以选择___________;完成此选择的实验,应该增加的仪器是____________(选择装置代号)。
5. 答案(1)① 2Na2O2+2H2O = 4NaOH+O2↑(3分) ② 用玻璃片在水面下盖住集气瓶口,将玻璃片与集气瓶一起移出水面,将盖有
玻璃片的集气瓶正放在桌上(3分)。
(2)① 经计算,烧瓶中c(OH-)约为1 mol/L;因为c(OH-)在1.0×10-4 mol/L~2.5
mol/L时酚酞呈红色,因此红色迅速褪去不是由于溶液中c(OH-)过大造成的
(3分)。
② 取烧瓶中的溶液于试管中,加入少量二氧化锰,有气泡放出,用带火星的木
条检验,木条着火,说明溶液中可能有H2O2存在。(3分)
③ 取②中试管里的溶液滴加酚酞试液,溶液变红且不褪色,说明“红色迅速褪
去”与H2O2的存在有关(3分)
5.利用下图所示装置制取氧气并进行相关的实验探究。
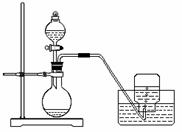
(1)将3.9 g过氧化钠放入烧瓶中,加入100 mLH2O,然后用排水法收集气体。 ① 过氧化钠跟水反应的化学方程式为________________________________。
② 集气瓶充满气体后,怎样从水槽中取出集气瓶?简述操作方法。 ______________________________________________________________
______________________________________________________________。
(2)已知:酚酞在c(OH-)在1.0×10-4 mol/L~2.5 mol/L时呈红色,且0.5 min内不会褪色;H2O2具有氧化性和漂白性。取上述实验得到的溶液于试管中,滴入2滴酚酞试液,溶液变红,片刻红色褪去。
① 有人认为,“红色迅速褪去”是由于溶液中c(OH-)过大造成的,试通过估算并
对比数据加以说明。
________________________________________________________________ _______________________________________________________________。 ② 还有人认为,“红色迅速褪去”是因为溶液中存在H2O2。试设计实验证明烧瓶
内的溶液中可能有H2O2存在,请简述实验操作。
__________________________________________________________________
_________________________________________________________________。
③ 补充实验,证明“红色迅速褪去”与溶液中存在H2O2有关。请简述实验操作。
__________________________________________________________________
_________________________________________________________________。
4. 答案(13分)其他正确结果参照本标准给分
(1)b(2分)
(2)常压时SO2的转化率已经很大,增大压强会增加动力成本和设备成本(2分);
压强一定时,温度升高SO2转化率下降(3分)
(3)6.23×105 kJ(3分)
4.硫酸工业生产应考虑综合经济效益。
(1)若从下列四个地区选址新建一座硫酸厂,最合适的地点应在_________附近。
a.风景旅游区 b.硫酸消耗中心区 c.人口稠密区 d.黄铁矿矿区
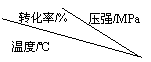 (2)工业生产硫酸的原料气成分(体积分数)为:SO2 7%,O2 11%,N2 82%。
(2)工业生产硫酸的原料气成分(体积分数)为:SO2 7%,O2 11%,N2 82%。
压强及温度对SO2转化率的影响如下:
|
|
0.1 |
0.5 |
1 |
10 |
|
400 |
99.2 |
99.6 |
99.7 |
99.9 |
|
500 |
93.5 |
96.9 |
97.8 |
99.3 |
|
600 |
73.7 |
85.8 |
89.5 |
96.4 |
工业上,二氧化硫催化氧化过程采用的是常压而不是高压,主要原因是
_____________________________________________________。
分析上表数据可知,二氧化硫的催化氧化是放热反应,理由是___________________________________________________________。
(3)据测算,接触法制硫酸过程中,每生产1 t 98%的硫酸需消耗3.60×105 kJ能量。
 若反应:2SO2(g)+O2(g) 2SO3(g),ΔH=-196.6 kJ /mol放出的热量完全被利
若反应:2SO2(g)+O2(g) 2SO3(g),ΔH=-196.6 kJ /mol放出的热量完全被利
用,则每生产1 t 98%的硫酸可为外界提供_____________kJ能量
(不考虑其他过程释放的能量)。
3..硫酸亚铁(FeSO4·7H2O)是一种重要的食品和饲料添加剂。实验室通过下列实验由废铁屑制备FeSO4·7H2O晶体:
①将5%Na2CO3溶液加入到盛有一定量废铁屑的烧杯中,加热数分钟,用倾析法除去Na2CO3溶液,然后将废铁屑用水洗涤2-3遍;
②向洗涤过的废铁屑中加入过量的稀硫酸,控制温度50-80℃之间至铁屑耗尽;
③趁热过滤,将滤液转入到密闭容器中,静置、冷却结品:
④待结晶完毕后,滤出晶体,用少量冰水洗涤品体2-3次,再用滤纸将晶体吸干:
⑤将制得的:FeSO4·7H2O晶体放在一个小广口瓶中,密闭保存。
请回答下列问题:
(1)实验步骤①的目的是__________,加热的作用是__________。
(2)实验步骤②明显不合理,理由是____________。
(3)实验步骤④中用少量冰水洗涤晶体,其目的是___________:__________。
(4)经查阅资料后发现,硫酸亚铁在不同温度下结晶可分别得到FeSO4·7H2O、FeSO4·4H2O和FeSO4·H2O。硫酸亚铁在不同温度下的溶解度和该温度下析出晶体的组成如下表所示(仅在56.7℃、64℃温度下可同时析出两种晶体)。
|
温度/℃ |
0 |
10 |
30 |
50 |
56.7 |
60 |
64 |
70 |
80 |
90 |
|
|
溶解度/g |
14.0 |
17.0 |
25.0 |
33.0 |
35.2 |
35.3 |
35.6 |
33.0 |
30.5 |
27.0 |
|
|
析出晶体 |
FeSO4·7H2O |
FeSO4·4H2O |
FeSO4·H2O |
||||||||
请根据表中数据作出硫酸亚铁的溶解度曲线。
 (5)若从硫酸亚铁溶液中结晶出FeSO4·4H2O晶体,应控制
(5)若从硫酸亚铁溶液中结晶出FeSO4·4H2O晶体,应控制
的结晶温度(t)的范围为__________。
3答案.(1)除油污 升高温度,溶液碱性增强,去油污能力增强 (2分)
(2)应该铁悄过量(或反应后溶液中必须有铁剩余)否则溶液中可能有Fe3+存在(3分)
 (3)洗涤除去晶体表面附着的硫酸等杂质用冰水洗涤可降低洗涤过程中FeSO4·7HZO的损耗(2分)
(3)洗涤除去晶体表面附着的硫酸等杂质用冰水洗涤可降低洗涤过程中FeSO4·7HZO的损耗(2分)
2.答案 ⑴①溶液蓝色恰好褪去所需的时间,吸收前后颗粒吸附剂、棉花、盛放容器的总质量
②同时加入少量碘化钾固体,用适量水使之完全溶解 将第一步所得溶液全部转入1000mL的容量瓶中,定容,摇匀
⑵①800 ②抽气速度过快,或装置气密性较差
③将50mL5×10-4mol/L的碘溶液的体积减小为5mL,并将广口瓶改为试管
⑶④ (每空2分,共14分
2.空气中的SO2含量和可吸入颗粒的含量(可用g/cm3表示)都是重要的空气质量指标。在工业生产上规定:空气中二氧化硫的最大允许排放浓度不得超过0.02mg/L。
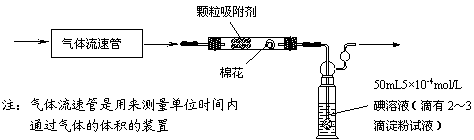 ⑴为测定某地方的空气中SO2和可吸入颗粒的含量,甲同学设计了如下图所示的实验装置:
⑴为测定某地方的空气中SO2和可吸入颗粒的含量,甲同学设计了如下图所示的实验装置:
①应用上述装置测定空气中的SO2含量和可吸入颗粒的含量,除测定气体流速(单位:cm3/min)外,还需要测定 。
②已知:碘单质微溶于水,KI可以增大碘在水中的溶解度。
请你协助甲同学完成100mL5×10-4mol/L碘溶液的配制:
第一步:准确称取1.27g碘单质加入烧杯中, ;
第二步: ;
第三步:从第二步所得溶液中,取出10.00mL溶液于100mL容量瓶中,加水稀释至刻度线。
⑵乙同学拟用下列简易装置测定空气中的SO2含量:准确移取50mL5×10-4mol/L的碘溶液,注入右图所示广口瓶中,加2-3滴淀粉指示剂,此时溶液呈蓝色。在指定的测定地点抽气,每次抽气100mL,直到溶液的蓝色全部褪尽为止,记录抽气次数(n)。
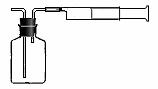 ①假设乙同学的测量是准确的,乙同学抽气的次数至少为 次,方可说明该地空气中的SO2含量符合排放标准。
①假设乙同学的测量是准确的,乙同学抽气的次数至少为 次,方可说明该地空气中的SO2含量符合排放标准。
②如果乙同学用该方法测量空气中SO2的含量时,所测得的数值比实际含量低,请你对其可能的原因(假设溶液配制、称量或量取及各种读数均无错误)提出合理假设:_______________________________________________________________。
③丙同学认为:乙同学的实验方案需要抽气的次数太多,操作麻烦。与乙讨论后,决定将抽气次数降到100次以下,请你设计合理的改进方案:
。
⑶改变合适的吸收液,乙同学使用的装置还可以测定新装修的居室空气中甲醛的浓度,吸收剂最好选用 (选填:①浓硫酸、②银氨溶液、③新制的氢氧化铜、④酸化的高锰酸钾溶液)。
1. 答案:⑴c d ⑵ ②⑤⑥⑧
1.⑴下列实验设计或操作合理的是_____________。
a.中和热测定实验时,如果没有环形玻璃棒,可用环形铜质搅拌棒代替。
b.实验室制肥皂时,将适量植物油、乙醇和NaOH溶液混合,并不断搅拌、加热,直到混合物变稠,即可得到肥皂。
c.实验室制取乙烯时必须将温度计的水银球插入反应液中,测定反应液的温度。
d.向Na2CO3与NaOH的混合溶液中加入足量的CaCl2溶液,再滴加几滴酚酞试液,可检验NaOH的存在。
e.将10滴溴乙烷加入1mL10%的烧碱溶液中加热片刻后,再滴加2滴2%的硝酸银溶液,以检验水解生成的溴离子。
⑵下列实验操作或对实验事实的描述不正确的是 (填序号)
① 用热的浓HCl洗涤附着有MnO2的试管;② 浓硫酸不小心沾在皮肤上,应用氢氧化钠溶液冲洗;③ 测定硫酸铜晶体中结晶水含量的实验中,至少需经过4次称量;④ 将乙烯、乙炔分别通入溴水中,乙烯使溴水的褪色速度快;⑤ 蒸馏石油时,冷凝管中的冷水应上进下出;⑥ 向蛋白质溶液中加入浓的无机盐(如Na2SO4、CuSO4)溶液,可使蛋白质盐析而分离提纯;⑦ 在试管中放入几片碎滤纸,滴几滴90%的浓硫酸,再将滤纸捣成糊状,微热并冷却后先滴入几滴CuSO4溶液再加入过量的NaOH溶液加热至沸腾,可观察到红色沉淀生成;⑧ 配制一定浓度的溶液时,若定容时不小心加水超过容量瓶的刻度线,应立即用滴管吸去多余的部分。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com