
题目列表(包括答案和解析)
20.(10分)化学电池在通讯、交通及日常生活中有着广泛的应用,目前常用的镍(Ni)镉(Cd)电池,其电池总反应可以表示为:

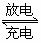
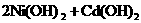
(1)下列有关镍镉电池总反应的说法中,正确的是________(填序号);
①以上反应是可逆反应
②以上反应不是可逆反应
③充电时化学能转变为电能
④放电时化学能转变为电能
(2)已知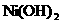 和
和 均难溶于水.有资料表明,一节废镍镉电池可以使一平方米面积的耕地失去使用价值,在酸性土壤中这种污染尤为严重.这是因为__________
均难溶于水.有资料表明,一节废镍镉电池可以使一平方米面积的耕地失去使用价值,在酸性土壤中这种污染尤为严重.这是因为__________
_____________________________________;
(3)另一种常用的电池是锂电池(锂是一种碱金属元素,其相对原子质量为7),由于它的比容量(单位质量电极材料所能转换的电量)特别大而广泛应用于心脏起搏器,一般使用时间可长达十年.电池总反应可表示为: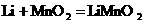 .试回答:
.试回答:
①锂电池比容量特别大的原因是_____________________________________________
____________________;
②锂电池中的电解质溶液需用非水溶剂配制,为什么这种电池不能使用电解质的水溶液?请用化学方程式表示其原因_______________________________________.
19.(10分)松油醇是一种调香香精,它是a 、b 、g 三种同分异构体组成的混合物,可由松节油分馏产品A(下式中的18是为区分两个羟基而人为加上去的)经下列反应制得:

试回答:
(1)a -松油醇的分子式________;a -松油醇所属的有机物类别是________.
(2)写结构简式:b-松油醇________,g -松油醇________,它们的关系是_____
_______________________________.
(3)a -松油醇能发生的反应类型是_________________________________________
________________________.
18.(10分)植物生长需要营养,实验室现有一包由氯化铵和硫酸铵混合而成的白色粉末,课外小组的同学按下图实验设计进行实验,测定这种混合物中各组分的含量,以便给植物施用.
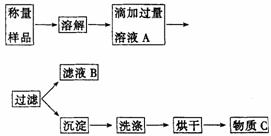
(1)溶液A中溶质的化学式_______________________________________________.
(2)他将样品放入托盘天平的右盘中,样品质量记录游码为0.4g,左边的托盘里的砝码为16g,则样品质量是________g.
(3)若过滤使用的仪器和用品已有:滤纸、铁架台、铁圈、烧杯、漏斗,还需要补充的仪器或用品是________________________.
(4)怎样证明滴加溶液A已经过量,简述操作方法____________________________
_____________________________________________________________________________.
(5)若物质C的质量为23.3g,那么原混合物中氯化铵的质量分数为________.
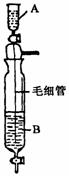
17.(10分)(1)在Inorganic Syntheses一书中,有一装置是用以制备某种干燥的纯净气体.如下图所示:其A中应盛放一种密度比B中密度小的液体.下表中为几种液体的密度
|
溶液名称 |
浓盐酸 |
浓硫酸 |
浓氨水 |
浓氢氧化 钠溶液 |
浓醋酸 |
|
密度(g/mL) |
1.19 |
1.84 |
0.89 |
1.41 |
1.06 |
现从上述液体中选出几种适宜的试剂来利用该装置制出干燥纯净气体.
(a)制备出的气体其化学式是____________________________.
(b)应选用的试剂(写名称):A中盛________B中盛________.
(c)装置中毛细管的作用是_______________________________________.
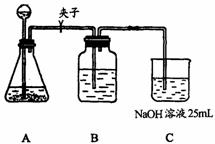
(2)某学生拟用50mL NaOH溶液吸收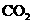 气体,制备
气体,制备 溶液.为了防止通入的
溶液.为了防止通入的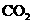 气体过量而生成
气体过量而生成 ,他设计了如下实验步骤:①取25mL NaOH溶液吸收过量的
,他设计了如下实验步骤:①取25mL NaOH溶液吸收过量的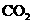 气体,至
气体,至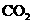 气体不再溶解;②小心煮沸溶液1-2分钟排出溶液中溶解的二氧化碳气体;③在得到的溶液中加入另一半(25mL)NaOH溶液,使溶液充分混合.
气体不再溶解;②小心煮沸溶液1-2分钟排出溶液中溶解的二氧化碳气体;③在得到的溶液中加入另一半(25mL)NaOH溶液,使溶液充分混合.
(a)他能否制得较纯净的 ?________.理由是_________________________
?________.理由是_________________________
_____________________________________________________________________________
________________.
按它的设计,第①步实验装置如下图所示:
(b)装置A使用的试剂是石灰石和盐酸溶液.可否使用纯碱代替石灰石?________,原因是____________________________________________________.
(c)装置B使用的试剂是________,作用是__________________________________
__________________________________________________________.
(d)有人认为实验步骤②③的顺序对调,即先混合,再煮沸,更合理,你认为对吗?为什么?
16.还原2.4×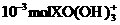 到X元素的低价态时,需消耗30mL0.2mol·
到X元素的低价态时,需消耗30mL0.2mol·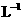 的亚硫酸钠溶液,则在此反应中X元素的低价态为( )
的亚硫酸钠溶液,则在此反应中X元素的低价态为( )
A.0价 B.+1价 C.-1价 D.-2价
第Ⅱ卷(非选择题,共56分)
15.甲、乙两同学从同一溶液中各取出100g做如下实验:甲将溶液蒸发掉20g水后冷却到室温,析出3.6g晶体(不含结晶水);乙将溶液蒸发掉30g水后冷却到室温,析出6.0晶体,若两同学实验都正确无误,则100g该溶液蒸发掉10g水并冷却到室温时,析出晶体的质量为( )
A.0 B.1.2g
C.2.4g D.9.6g
14.在硫酸铝、硫酸钾和明矾的混合溶液中,如果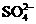 的离子浓度为0.2mol·
的离子浓度为0.2mol·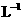 ,当加入等体积0.2mol·
,当加入等体积0.2mol·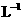 KOH溶液时,生成的沉淀恰好完全溶解,则反应后混合溶液中
KOH溶液时,生成的沉淀恰好完全溶解,则反应后混合溶液中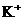 离子浓度约是( )
离子浓度约是( )
A.0.125mol·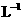 B.0.225mol·
B.0.225mol·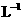 C.0.250mol·
C.0.250mol·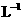 D.0.450mol·
D.0.450mol·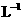
13.欲使 稀溶液中
稀溶液中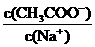 比值增大,可采取的措施是( )
比值增大,可采取的措施是( )
A.升温 B.加水稀释 C.加少量的KOH固体 D.加少量固体
12.在复印室工作时会闻到一股特殊的气味,离复印机越近,该气味越浓.若用润湿的KI淀粉试纸接近该气体,则试纸会变蓝,则该物质的化学式是( )
A.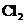 B.
B. C.
C.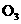 D.
D.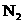
11.以酚酞试液为指示剂,对某新制的NaOH溶液进行中和滴定实验.数据记录如下表:
|
项目 |
待测液 |
消耗标准盐酸 (0.1mol/L)的体积 |
|
① |
20mL NaOH溶液 |
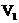 mL mL |
|
② |
20mL NaOH溶液+10mL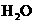 10mL 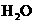 |
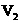 mL mL |
|
③ |
敞口隔夜放置的20mL NaOH溶液 |
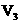 mL mL |
该新制的NaOH溶液的浓度c(NaOH)合理的是( )
A.c(NaOH)=0.10×(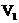 +
+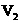 +
+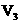 )/(3×20)mol·
)/(3×20)mol·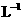
B.c(NaOH)=0.10×(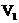 +
+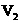 )/(2×20)mol·
)/(2×20)mol·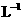
C.c(NaOH)=0.10×(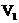 +
+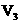 )/(2×20)mol·
)/(2×20)mol·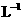
D.c(NaOH)=0.10×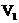 /20mol·
/20mol·
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com