
题目列表(包括答案和解析)
11.某校一研究性学习小组进行乙酸乙酯的制备及相关探究实验。
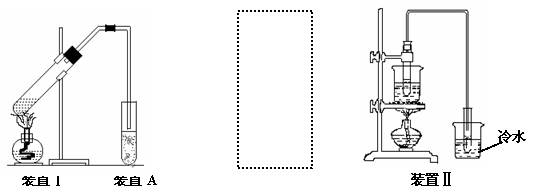
操作步骤:(1)如图装置Ⅰ所示,组装好实验装置。
(2)加入乙醇、乙酸及浓硫酸,点燃酒精灯缓慢加热。
(3)将产生的蒸气经导管导入装置A中,观察现象。
回答下列问题:
(1)(a)请写出该反应的反应方程式:____________________________________________
(b)该实验从安全角度考虑,应注意方面有: (多选倒扣分)
① 加入试剂时,浓硫酸应最后缓缓加入;
② 为防止暴沸,应加入沸石;
③ 防止受热不均匀而产生倒吸。
(2)某同学在做实验时,为防止倒吸,对A装置进行的改进,请在右边虚框中画出改进部分装置图。
(3)若该同学用46g乙醇与30g 乙酸充分反应,结果生成乙酸乙酯的质量为17.6g,请计算该反应的产率为 ,分析可能的原因? (多选倒扣分)
① 反应过程中升温过快过高,从而使一部分反应物未来得及充分反应;
② 该反应为可逆反应,反应不能进行彻底;
③ 生成的乙酸乙酯未能充分冷凝下来
(4)为了提高反应物的利用率,另一同学认为采用了装置Ⅱ,你认为有何优点?
(5)研究性学习小组进一步探究乙酸乙酯的制备实验。
(1) 该实验进行前必须进行的一步操作是_________
(2) 已知反应物为CH3COOH和CH3CH218OH反应,一段时间后,18O还应存在于_______(填化学式)。
(3) 反应一段时间后,向A中滴加几滴石蕊、试液,现象为出现三层颜色,上层为红色,中间为紫色,下层为蓝色;再充分振荡后,溶液分两层,上层液体变为无色且体积变小,下层溶液为蓝色且体积变大。请用离子方程式及简要文字解释振荡后现象变化的原因:
(4)为了将得到的乙酸乙酯从混合液中分离出来,应采用的操作方法是_______(填名称),所用的典型玻璃仪器有_____________。
(5)为了验证乙酸乙酯的水解反应,请设计一个实验进行(所用无机试剂任选)
10. A晶体是一种矾,溶于水可电离出三种离子。用A进行如下实验:
①准确称量3.92g晶体溶于适量的稀硫酸,配成100mL浅绿色溶液X
②取少量X于试管中滴加KSCN溶液,无现象,再滴加氯水,溶液呈红色
③取20.00mLX于锥形瓶中,用0.02mol/LKMnO4溶液滴定(酸性KMnO4被还原成Mn2+,Mn2+在溶液中几乎呈无色),当到达终点时,用去KMnO4溶液20.00mL
④取20.00mLX于试管中加入浓NaOH溶液加热,生成的气体能使湿润的红色石蕊试纸变蓝且恰好能被40.00mL0.10mol/LHCl溶液完全吸收
⑤另取20.00mLX向其中加入足量的BaCl2溶液,将沉淀过滤、洗涤,反复烘干并称量得1.00g。
试回答下列问题:
⑴本实验的目的是 。
⑵把A溶于稀硫酸而不直接溶于水的原因是 。
⑶第③步操作中,对滴定管的使用主要有以下几步:a用蒸馏水洗涤;b 必要操作;c装入标准液;d 赶走尖嘴部分的气泡;e 调节液面在“0或0刻度”以下。上述b步骤的必要操作是 ;若无此步骤则会使该离子在A晶体中的含量 (填“偏高”、“偏低”或“不变”)。
⑷第⑤步中证明沉淀洗净的操作是 。
⑸此实验中有一步设计错误,它是第 步(填编号),正确地设计应为
。
⑹如果通过实验测得3.92g晶体中含有的阴离子全部形成钡盐沉淀的质量为4.66g,则A的化学式为 。
10答案.测定A晶体的组成 (每空2分)
⑵抑制Fe2+的水解
⑶用0.02mol/LKMnO4溶液润洗滴定管两次 ;偏高
⑷取最后的洗出液少许滴加稀硫酸,若无沉淀则证明已洗净 (其它合理试剂也行)
⑸⑤ ;直接取一定量A向其中加入稀盐酸,再加入足量的BaCl2溶液,观察
⑹(NH4)2Fe(SO4)2·6H2O
9.答案(12分)Ⅰ.操作麻烦、乙醇转化率低(其它合理答案均可)(2分)
Ⅱ.(1)使生成乙醇蒸气的速率加快(1分)
(2)①放热
(1分) 2CH3CH2OH+O2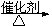
 2CH3CHO+H2O (2分)
2CH3CHO+H2O (2分)
②控制甲中单位时间内的气泡数 带走过多热量,难以保证反应所需温度 反应放热太少,不能达到反应所需温度 (3分)
(3) b a (2分) 冰水 (1分)
9.(12分)Ⅰ.中学课本中介绍了如下实验:把一端弯成螺旋状的铜丝放在酒精灯外焰加热,待铜丝表面变黑后立即把它插入盛有约2 mL乙醇的试管里,反复操作几次。请你评价若用上述方法制取乙醛存在哪些不足(写出两点)。
Ⅱ.某课外活动小组利用下图装置进行乙醇的催化氧化实验并制取乙醛,图中铁架台等装置已略去,粗黑线表示乳胶管。请填写下列空白:

(1)甲装置常常浸在70-80℃的水浴中,目的是 。
(2)实验时,先加热玻璃管乙中的镀银铜丝,约1分钟后鼓入空气,此时铜丝即呈红热状态。若把酒精灯撤走,控制一定的鼓气速度,铜丝能长时间保持红热直到实验结束。
①乙醇的催化氧化反应是________反应(填“放热”或“吸热”),该反应的化学方程式为 。
②控制鼓气速度的方法是 ,若鼓气速度过快则会 ,若鼓气速度过慢则会 。
(3)若试管丁中用水吸收产物,则要在导管乙、丙之间接上戊装置,其连接方法是(填戊装置中导管代号):乙接 、_______接丙;若产物不用水吸收而是直接冷却,应将试管丁浸在 _____ 中。
8. 利用右图装置测定中和热的实验步骤如下:
①
|
 杯中,
测出硫酸
杯中,
测出硫酸
温度为25.0℃
②
 用另一量筒量取50mL 0.55mol·L-1 NaOH
用另一量筒量取50mL 0.55mol·L-1 NaOH
|
|
计测出其温度为25.2℃
③
 将NaOH溶液倒入小烧杯中,设法使之混合均匀,测得混合液
将NaOH溶液倒入小烧杯中,设法使之混合均匀,测得混合液
最高温度为28.5℃。
回答下列问题:
(1)为什么所用NaOH溶液要稍过量?
(2)倒入NaOH溶液的正确操作是 : (从下列选出)
A.沿玻璃棒缓慢倒入 B. 分三次少量倒入 C. 一次迅速倒入
(3)使硫酸与NaOH溶液混合均匀的正确操作是 (从下列选出)
A.用温度计小心搅拌 B.揭开硬纸片用玻璃棒搅拌
C. 轻轻地振荡烧杯 D. 用套在温度计上的环形玻璃棒轻轻的搅动
(4)设溶液的的密度均为1g·cm-3,中和后溶液的比热容 C=4.18J·(g·℃)-1,则该反应中和热的实验值为___________________,中和反应热化学方程式是 ________________________;
(5) 上述实验中中和热的实验值往往小于理论值,其主要原因是(设操作无误)
请提出改进措施
(1)确保硫酸被完全中和 (2)C (3)D
(4)56.8KJ·mol-1(热化学方程式略)
(5)碎纸条的保温性能欠佳。用棉花(或其它保温性能良好的材料)代替碎纸条,或用真空玻璃瓶代替烧杯。
7. 答案(1)①产生黄绿色气体,并慢慢向上口移动。(3分)
②H2的扩散速度快,Cl2:的扩散速度慢,最初形成的是H2和空气的混合气体(3分)。
(2)①2.45(3分)
②不合理(1分),稀硝酸能将SO32-氧化为SO42-(1分),过量的Na2O2能将NaSO3氧化成NaSO4(1分)。
(3)在a中加醋酸和Na2CO3,在b中加苯酚钠溶液,验证醋酸、碳酸、苯酚的酸性强弱
(其它合理答案也可给分,共3分)
7.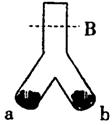 如图,在倒Y型管中可完成很多实验,
如图,在倒Y型管中可完成很多实验,
(1) 在a处加Zn粉,b处加KMnO4固体,然后从上口同时
加适量盐酸。①b中的现象是___________;
②某同学立即在B处点燃镁条,但看不到爆炸的现象
(a、 b中的实验现象均较明显);请分析实验失败的原因
是__ 。
(2)如在a处加1.38gNa,在b处加KCIO3和MnO2的混合物,密封后在a、b处同时加热,a处有Na2O2生成
①若反应后管内空气组成没有变化,则应加KCIO3____________g.
②某同学将a处生成的Na2O2:取出再与SO2反应得到固体物质和氧气,他认为反应除了生成Na2SO3和O2外,还有Na2SO4。生成,为了证明是否有Na2SO4生成,他设计了如下方案:
 将固体溶于水
白色沉淀
沉淀部分溶解→专证明原固体物质含有Na2SO4.
将固体溶于水
白色沉淀
沉淀部分溶解→专证明原固体物质含有Na2SO4.
上述方案是否合理?___________请说明两点理由:一、__________ 二、__________。
(3)利用此仪器还可以完成其它实验(举一例):________。
11.(1)①bcacd(2分);吸收NH3,防止空气中的水气进入(1分);浓氨水(1分)
②M(Cu)=18m(Cu)/m(H2O)(2分)
(2)①AD(2分)。 ②B(1分);bde(3分)
1.(1)搅拌加速溶解;搅拌防止液体和固体飞溅;引流(每空1分)
(2)静置,向上层清夜中继续滴加NaOH溶液(2分)
(3)用玻璃棒引流向过滤器中加入蒸馏水,待液体滤出后,重复2~3次(2分);洗去固体表面残留的Na+和SO42-(1分)。
6. 答案(20分)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com