
题目列表(包括答案和解析)
3.(1)在析出NaHCO3晶体的同时会析出少量NaCl、NH4CI、NH4HCO3等少量杂质,加热时NH4CI、N4HCO3不稳定已分解逸出。 (2)干燥CO2
(3)(10分)
|
甲 |
84.8% |
失败 |
装置A内等会残留许多CO2,不能充分被C中吸收而偏低 |
|
乙 |
95.4% |
成功 |
|
2、(1)N2、O2的体积 (2)偏低 (3)酸性高锰酸钾溶液或溴水
(4)VSO2%=22.4CVa/(22.4CVa+Vb)×100%(其它合理答案也给分)
(5)bceg或beg或ceg
1、方法1:(1)2Na2O2+2H2O=4NaOH+O2↑ Na2O+H2O=2NaOH
(2)⑤①④ (3)(G)接(A)(B)接(F)
方法2 (1)2Na2O2+2CO2=2Na2CO3+O2 Na2O+CO2=Na2CO3 (2)⑤②⑥⑦①④
(3) (G)接 (D)(C) 接 (H)(I)[或(I)(H)] 接(J)(K) (或(K)(J)) 接(A)(B) 接(F)
6、用下面两种方法可以制得白色的Fe(OH)2沉淀。
 方法一:用不含Fe3+的FeSO4溶液与用不含O2的蒸馏水配制的NaOH
方法一:用不含Fe3+的FeSO4溶液与用不含O2的蒸馏水配制的NaOH
溶液反应制备。
(1)用硫酸亚铁晶体配制上述FeSO4溶液时还需加入 。
(2)除去蒸馏水中溶解的O2常采用 的方法。
(3)生成白色Fe(OH)2沉淀的操作是用长滴管吸取不含O2的NaOH
溶液,插入FeSO4溶液液面下,再挤出NaOH溶液。这样操作的理
由是 。
方法二:在如图装置中,用NaOH溶液、铁屑、稀H2SO4等试剂制备。
(1)在试管Ⅰ里加入的试剂是 。
(2)在试管Ⅱ里加入的试剂是 。
(3)为了制得白色Fe(OH)2沉淀,在试管Ⅰ和Ⅱ中加入试剂,打开止水夹,塞紧塞子后的实验步骤是 。
(4)这样生成的Fe(OH)2沉淀能较长时间保持白色,其理由是 。
参考作案:
5、(98年上海)用下列仪器、药品验证由铜和适量浓硝酸反应产生的气体中含NO(仪器可选择使用,N2和O2的用量可自由控制)。
已知:①NO+NO2+2OH-→2NO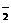 +H2O②气体液化温度:NO2 21℃ NO -152℃
+H2O②气体液化温度:NO2 21℃ NO -152℃
试回答:(1)仪器的连接顺序(按左→右连接,填各接口的编号)为
(2)反应前先通入N2目的是 (3)确认气体中含NO的现象是 (4)装置F的作用是
(5)如果O2过量,则装置B中发生反应的化学方程式为:
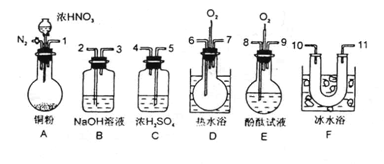
4. 已知某纯碱试样中含有NaCl杂质,为测定试样中纯碱的质量分数,可用下图中的装置进行实验。
已知某纯碱试样中含有NaCl杂质,为测定试样中纯碱的质量分数,可用下图中的装置进行实验。
主要实验步骤如下:
①按图组装仪器,并检查装置的气密性
②将a g试样放人锥形瓶中,加适量蒸馏水溶解,得到试样溶液
③称量盛有碱石灰的U型管的质量,得到b g
④从分液漏斗滴人6mol·L-1 的硫酸,直到不再产生气体时为止
⑤从导管A处缓缓鼓人一定量的空气
⑥再次称量盛有碱石灰的U型管的质量,得到c g
⑦重复步骤⑤和⑥的操作,直到U型管的质量基本不变,为d g
请填空和回答问题:
(1) 在用托盘天平称量样品时,如果天平的指针向左偏转,
说明
(2)装置中干燥管B的作用是
(3)如果将分液漏斗中的硫酸换成浓度相同的盐酸,测试的结果 (填偏高、偏低或不变)
(4)步骤⑤的目的是
(5)步骤⑦的目的是
(6)该试样中纯碱的质量分数的计算式为
(7)还可以用其他实验方法测定试样中纯碱的质量分数。请简述一种不同的实验方法。
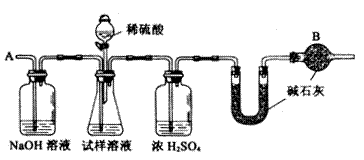
3.工业制纯碱,是向饱和食盐水中通入氨气和二氧化碳,获得碳酸氢钠晶体,它的反应原理可用下列方程式表示:
NH3+CO2+H2O=NH4HCO3 ①
NH4HCO3+NaC1(饱和)=NaHCO3↓+NH4Cl ②
将所得碳酸氢钠晶体加热分解即可得到纯碱。请回答:
(1)工业所制纯碱中常含少量的氯化钠杂质,其原因是___________
(2)下列装置图中B内浓硫酸的作用是____________
(3)现有甲、乙二个小组的学生,欲测定某工业纯碱样品中Na2CO3的质量分数,分别设计
并完成实验如下:
甲组:取10.00g样品,利用上图所示装置,测出反应后装置C中碱石灰的增重为3.52g
乙组:取10.00g样品,配成1000ml溶液,用碱式滴定管量取25.00ml放入锥形瓶中,加入甲基橙作指示剂,用0.150mol·L-1的标准盐酸溶液滴定至终点(有关反应为Na2CO3+2HCI=2NaCI+H2O+CO2↑)。完成三次平行实验后,消耗盐酸体积的平均值为30.00ml。
请分析计算后填表:
|
|
样品中Na2CO3的质量分数 |
对实验结果的评价(成功或失败) |
实验失败的主要原因以及对实验结果的影响 |
|
甲 组 |
|
|
|
|
乙 组 |
|
|
|
2、工业上测量SO2、N2、O2混合气体中SO2含量的装置如下图;反应管中装有碘的淀粉溶液。SO2和I2发生的反应为(N2、O2不与I2反应):SO2+I2+2H2O→H2SO4+2HI
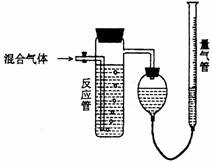 (1)混合气体进入反应管后,量气管内增加的水
(1)混合气体进入反应管后,量气管内增加的水
的体积等于 的体积(填写气体的分子式)。
(2)反应管内溶液蓝色消失卮,没有及时停止通
气,则测得的SO2含量 (选填:偏高,偏
低,不受影响)。
(3)反应管内的碘的淀粉溶液也可以用 代
替(填写物质名称)。
(4)若碘溶液体积为VamL.,浓度为Cmol·L-1,
N2与O2的体积为VbmL(已折算为标准状况下
的体积)。用C、Va、Vb表示SO2的体积百分含量为: 。
(5)将上述装置改为简易实验装置,除导管外,还需选用的仪器为. (选下列仪器的编号)。
a.烧杯 b.试管 c.广口瓶 d.容量瓶 e.量筒 f.单孔塞 g.双孔塞
1、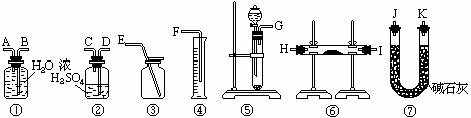 现有一定量含有Na2O杂质的Na2O2试样.请从下图中选用适当的实验装置,设计一个最简单的实验,测定Na2O2试样的纯度(可供选用的反应物只有CaCO3固体,6摩尔/升盐酸和蒸馏水).。请填写下列空白:
现有一定量含有Na2O杂质的Na2O2试样.请从下图中选用适当的实验装置,设计一个最简单的实验,测定Na2O2试样的纯度(可供选用的反应物只有CaCO3固体,6摩尔/升盐酸和蒸馏水).。请填写下列空白:
(1)写出实验中Na2O2和Na2O分别发生反应的化学方程式
(2)应选用的装置是(只要求写出图中装置的标号)
(3)所选用装置的连接顺序应是(填各接口的字母;连接胶管省略).
25.(1)④③⑥ (2)G接F E接J
(3)先向试管中加入一定量的稀H2SO4,(能没过锌片),将试管倾斜,小心地将锌片贴在试管壁上,塞好胶塞,连好装置,再将试管直立,使锌与稀H2SO4反应。
(4)设收集H2 VmL(标准状况),Zn的原子量为x
H2SO4+Zn=ZnSO4+H2↑
x 22.4L
W V×10-3L
x= 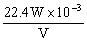
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com