
题目列表(包括答案和解析)
2. 氢元素与其他元素形成的二元化合物称为氢化物,下面关于氢化物的叙述正确的是
A.一个D2O分子所含2的中子数为8
B.NH3的结构式为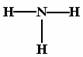
C.HCl的电子式为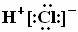 D.热稳定性:H2S>HF
D.热稳定性:H2S>HF
1. 空气是人类生存所必需的重要资源。为改善空气质量而启动的“蓝天工程”得到了全民的支持。下列措施不利于“蓝天工程”建设的是
A.推广使用燃煤脱硫技术,防治SO2污染
B.实施绿化工程,防治扬尘污染
C.研制开发燃料电池汽车,消除机动车尾气污染
D.加大石油、煤炭的开采速度,增加化石燃料的供应量
27.(14分)
钴(Co)化合物对化学键的研究起着重要的作用。为测定某钴化合物[Co(NH3)x Cly]Clz的组成,进行如下实验:
① 称取样品0.5010g ,加入过量的NaOH溶液,煮沸,蒸出所有的氨,冷却,得到A。产生的氨用50.00mL 0.5000mol·L-1 的盐酸完全吸收并用蒸馏水定容到100mL,得溶液B,取B溶液20.00mL , 用0.1000mol·L-1 NaOH滴定,消耗NaOH溶液30.00mL。
② 向A中加入过量的KI固体,振荡,盐酸酸化后置于暗处,发生反应:
Com+ + I- → Co2+ + I-(未配平)
反应完成后,蒸馏水稀释,用Na2S2O3溶液滴定析出的I2,消耗0.1000mol·L-1Na2S2O3溶液20.00mL 。反应方程式为:I2 + 2Na2S2O3 = 2NaI + Na2S4O6
③ 另称取该物质样品0.2505g,溶于水,以0.1000mol·L-1AgNO3溶液滴定至恰好反应完全,消耗AgNO3溶液20.00mL。相应反应式为:
[Co(NH3)x Cly]Clz + zAgNO3=[Co(NH3)x Cly](NO3)z + zAgCl↓
通过计算求:
⑴[Co(NH3)x Cly]Clz中氮元素的质量分数。
⑵该钴化合物的化学式。
2006年普通高等学校招生全国统一考试
26.(6分)
地球化学中,通常用热重分析研究矿物在受热时质量变化以确定其组成。取66.6mg由高岭石[Al4Si4O10(OH)8]和方解石(CaCO3)组成的矿物,加热,在673K-1123K区间内分解为氧化物,样品总失重13.8mg 。
⑴方解石失重的百分比为______________。
⑵计算矿物中高岭石的质量分数。
25.(10分)
纤维素是自然界最为丰富的可再生天然高分子资源。
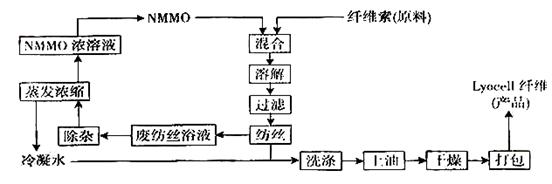
⑴纤维素可制备用于造纸、纺织等的胶粘纤维[成分是(C6H10O5) n],生产过程涉及多个化学反应。工艺简图如下:

近来,化学家开发了一种使用NMMO加工纤维素的新方法,产品“Lyacell纤维”成份也是(C6H10O5) n。工艺流程示意图如下:
① “Lyacell纤维”工艺流程中,可充分循环利用的物质是:_________________________。
② 与“Lyacell纤维”工艺相比,粘胶纤维工艺会产生含有______(只填非金属元素符号)的废物。并由此增加了生产成本。
③“Lyacell纤维”被誉为“21世纪的绿色纤维”,原因是:_________________________。
⑵“Lyacell纤维”工艺流程中的NMMO按以下合成路线制备(反应条件均省略):
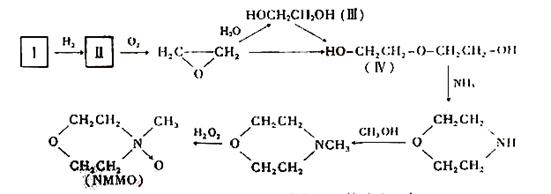
其中,化合物Ⅰ可三聚为最简单的芳香烃,化合物Ⅱ可使溴水褪色。
① 化合物Ⅰ也可聚合为在一定条件下能导电的高分子化合物,该高分子化合物的化学式为:_________________________。
② 化合物Ⅱ与O2反应的原子利用率达100%,其化学方程式为:_________。
③ 关于化合物Ⅲ、Ⅳ的说法正确的是:_________(填代号)
A.都可发生酯化反应 B.Ⅲ可被氧化,Ⅳ不可被氧化
C.都溶于水 D.Ⅲ可与钠反应,Ⅳ不可与钠反应
E.Ⅲ是乙醇的同系物 F.Ⅲ可由卤代烃的取代反应制备
④ 写出合成NMMO最后一步反应的化学方程式:__________________________________。
4.(8分)
环丙烷可作全身麻醉剂,环已烷是重要的有机溶剂。下面是部分环烷烃及烷烃衍生物的结构简式、键线式和某些有机化合物的反应式(其中Pt、Ni为催化剂)。
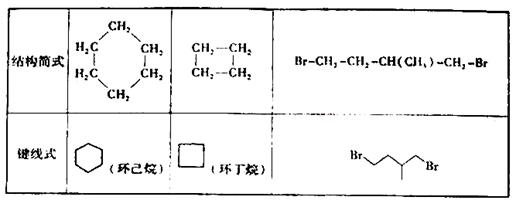
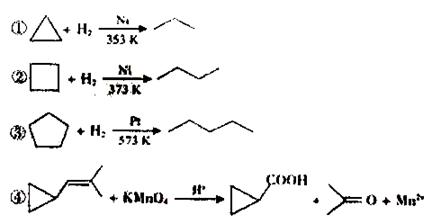
回答下列问题:
⑴环烷烃与___是同分异构体。
⑵从反应①-③可以看出,最容易发生开环加成反应的环烷烃是:______(填名称)。
⑶环烷烃可与卤素单质、卤化氢发生类似的开环加成反应,如环丁烷与溴化氢在一定条件下反应,其化学方程式为:_______________(不需注明反应条件)。
⑷写出鉴别环丙烷和丙烯的一种方法,试剂:________,现象与结论:__________________________________________。
23.(8分)
水体中重金属铅的污染问题备受关注。水溶液中铅的存在形态主要有Pb2+、Pb(OH)+、Pb(OH)2、Pb(OH)3-、Pb(OH)42-,各形态的浓度分数α随溶液p H变化的关系如下图所示:
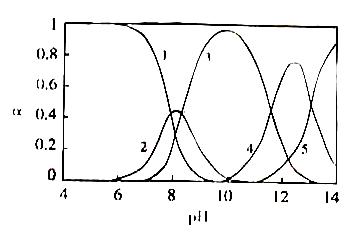
[1表示Pb2+、2表示Pb(OH)+、3表示Pb(OH)2、4表示Pb(OH)3-、5表示Pb(OH)42-]
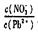 ⑴Pb(NO3)2溶液中
____2(填“>”、“<”或“=”);往该溶液中滴入氯化铵溶液后, 增加,可能的原因是:_________________________________________________。
⑴Pb(NO3)2溶液中
____2(填“>”、“<”或“=”);往该溶液中滴入氯化铵溶液后, 增加,可能的原因是:_________________________________________________。
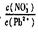 ⑵往Pb(NO3)2溶液中滴入稀NaOH溶液,pH=8时溶液存在的阳离子( Na+除外 )有:_______。
⑵往Pb(NO3)2溶液中滴入稀NaOH溶液,pH=8时溶液存在的阳离子( Na+除外 )有:_______。
pH=9时主要反应的离子方程式是:_______________________________________________。
⑶某课题组制备了一种新型脱铅剂,能有效去除水中的痕量铅,实验结果如下表:

上表中除 Pb2+ 外,该脱铅剂对其他离子的去除效果最好的是:________________________>
⑷如该脱铅剂(用EH表示)脱铅过程中主要发生的反应为:
2 EH(s) + Pb2+ = E2Pb(s) + 2 H+
则脱铅最合适的pH范围为_______(填代码)。
A.4-5 B.6-7 C.9-10 D.11-12
22.(13分)
往有机聚合物中添加阻燃剂,可增加聚合物的使用安全性,扩大其应用范围。例如:在某聚乙烯树脂是加入等质量由特殊工艺制作的阻燃材料Mg(OH)2,树脂的可燃性可大大降低。该Mg(OH)2的生产工艺如下:
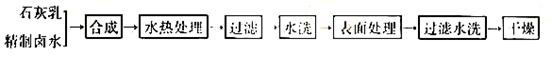
⑴精制卤水中的MgCl2 与适量石灰乳反应合成碱式氯化镁[Mg(OH)2-x Clx·m H2O],反应的化学方程式为:______________________________________________________________。
⑵合成反应后,继续在393K-523K下水热处理8小时,发生反应:
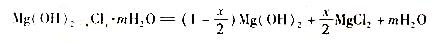
水热处理后,过滤、水洗。水洗的目的是:_________________________________________。
⑶阻燃型Mg(OH)2 具有颗粒大、易分散、与高分子材料相容性好等特点,上述工艺流程中与此有关的步骤是:________________________________。
⑷已知热化学方程式:
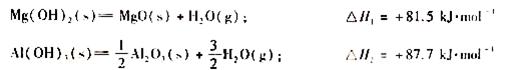
① Mg(OH)2 和Al(OH)3 起阻燃作用的原因主要是:________________________________。
② 等质量的Mg(OH)2 和Al(OH)3 相比,阻燃效果较好的是:_______________,原因是:
_____________________________________________________________________________。
⑸常用阻燃剂有三类:A.卤系,如四溴乙烷;B.磷系,如磷酸三苯酯;C.无机类,主要是Mg(OH)2 和Al(OH)3。从环保的角度考虑,应用时较理想的阻燃剂是:______(填代号),理由是:____________________________________________________________________。
21.(12分)
某研究性学习小组进行与NH3有关的系列实验。
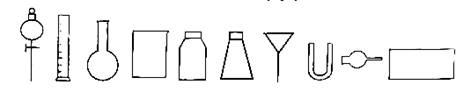
⑴从下图中挑选所需的仪器,画出制取氨气的装置图(添加必要的塞子、玻璃导管、胶皮管、固定装置和尾气处理装置不用画),并标明所和试剂。
⑵将NH3通入溴水中,有N2生成,反应方程式为:_________________________________。
⑶为验证“同温同压下,相同体积的任何气体具有相同数目的分子”,该小组同学设计了如图所示的装置,图中B管的容积是A管的2倍,活塞K1、K2、K3、K4、K5均关闭(固定装置和尾气处理装置略;HCl和NH3均不溶于石蜡油;装置气密性好)。
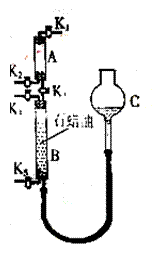 ①在A管中充满与大气压强相等的干燥HCl气体。
①在A管中充满与大气压强相等的干燥HCl气体。
操作是:__________________________________。
控制活塞K4、K5,调节C,使B管充满与A管同压的
干燥的NH3。
②缓慢开启活塞K3,A管中的现象是:___________。
要达到实验目的,当反应完成并恢复到室温时,B管
中预期的现象是:_____________________________;
若观察不到预期的现象,主要原因是:____________
______________________________________________。
20.(12分)
氧化铜有多种用途,如作玻璃着色剂、油类脱硫剂等。为获得纯净的氧化铜以探究其性质,某同学用工业硫酸铜(含硫酸亚铁等杂质)进行如下实验:
⑴制备氧化铜
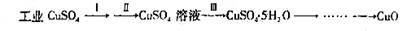
① 步骤Ⅰ的目的是除不溶性杂质,操作是:____________________________________。
② 步骤Ⅱ的目的是除铁,操作是:滴加H2O2溶液,稍加热;当Fe2+完全转化后,慢慢加入Cu2(OH)2CO3粉末,搅拌,以控制pH =3.5;加热煮沸一段时间,过滤,用稀硫酸酸化滤液至pH =1。控制溶液pH =3.5的原因是:_____________________。
③ 步骤Ⅲ的目的是得到CuSO4·5H2O固体,操作是:____________、过滤、水浴加热烘干。水浴加热的特点是:____________________________________________。
⑵探究氧化铜的性质
① 取A、B两支试管,往A中加入适量的CuO粉末,再分别向A和B加入等体积3% H2O2溶液,只观察到A中有大量气泡,结论是:___________________________________。
② 为探究试管A中的反应速率,收集气体并测定其体积必需的实验仪器有:_____。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com