
题目列表(包括答案和解析)
10、用“>”,“=”或“<”填空:
(1)元素A、B位于元素周期表的同一周期,已知等物质的量浓度的AClx溶液的PH值小于BCly溶液的PH,则x y;
(2)将一定量的氨气通入到盐酸中,溶液的PH恰好等于7时,则氨气的物质的量 盐酸HCl的物质的量;
(3)向等体积等物质的量浓度的盐酸和氯化铵溶液中加入的量的镁粉,镁粉完全反应后,盐酸溶液中放出的气体的体积 氯化铵溶液中放出气体的体积;
(4) 已知HCN(氢氰酸)为很弱的酸,向等体积的PH=10的NaOH溶液和PH=10的NaCN(氰化钠)溶液中分别不断地滴加同浓度的稀盐酸至PH=9,则消耗盐酸的体积:
前者 后者;
(5)PH=12的NaOH溶液a mL与PH=2的H2SO4溶液b mL混合后,混合溶液恰好呈中性,则a b。
9、(1)KHSO4溶液显 性(填“酸”或“碱”),
其原因是(用电离方程式表示) ;
(2) KHCO3溶液显 性(填“酸”或“碱”),
其原因是(用离子方程式表示) ;
(3) 将上述两溶液混合,离子反应方程式为 。
8、常温下将稀NaOH溶液与稀CH3COOH溶液混合,不可能出现的结果是( )
A、PH = 7,且C(CH3COO-) = C(Na+) > C(H+) = C(OH-)
B、PH > 7,且C(OH-) > C(Na+) > C(H+) > C(CH3COO-)
C、PH = 7,且C(Na+) + C(H+) = C(OH-) + C(CH3COO-)
D、PH < 7,且C(CH3COO-) > C(H+) > C(Na+) > C(OH-)
7、25℃时,在某物质的溶液中,由水电离出的H+的浓度为1×10-amol/L,下列说法正确的是( )
A、a<7时,水的电离受到抑制 B、a>7时,水的电离受到促进
C、a<7时,溶液的PH一定等于a D、a>7时,溶液的PH一定等于14-a
6、为了配制C(NH4+)与C(Cl-)之比为1׃1的溶液,可在NH4Cl溶液中加入下列物质①适量的HCl ②适量的NaCl ③适量的氨水 ④适量的NaOH ⑤适量的(NH4)2SO4中的( )
A、①② B、③④ C、③⑤ D、④⑤
5、室温下,在相同体积的浓度均为0.5mol/L的下列四种溶液①KCl ②FeCL3 ③HF ④Na2CO3中,所含阳离子的数目由多到少的顺序是( )
A、④>①>②>③ B、①>④>②>③ C、④>②>①>③ D、④>①>③>②
4、有一支50mL的碱式滴定管,其中盛有0.1mol/L的NaOH溶液,液面恰好在20.00mL刻度处,试问将管内的碱液全部放完能中和30mL盐酸,则对此盐酸的浓度表述正确的是( )
A、0.067mol/L B、小于0.1mol/L C、0.1mol/L D、大于0.1mol/L
3、下列是一段关于中和滴定的实验叙述:“①取用蒸馏水洗净锥形瓶,②用待测液(未知浓度的盐酸)润洗锥形瓶,然后向其中注入25mL的待测液,③向锥形瓶滴入几滴酚酞试液作指示剂,④另取一支酸式滴定管,经蒸馏水洗净后,⑤直接往滴定管中注入标准NaOH溶液,进行滴定,⑥一旦发现溶液由无色变成粉红色,即停止滴定,记录数据。”其中错误的有( )
A、④⑤⑥ B、②④⑤⑥ C、②④⑤ D、②⑤⑥
2、关于小苏打的水溶液的表述正确的是( )
A、C(Na+) = C(HCO3-) + C(CO32-) + C(H2CO3)
B、C(Na+) + c(H+) = C(HCO3-) + C(CO2-) + C(OH-)
C、HCO3-的电离程度大于水解程度
D、存在的电离只有:NaHCO3 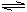 Na+ + HCO3- ; HCO3-
Na+ + HCO3- ; HCO3- 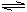 H+ + CO32-
H+ + CO32-
1、甲酸的下列性质中不能证明甲酸是弱电解质的是( )
A、1mol/L甲酸溶液的pH值约为2;
B、10ml0.1mol/L的甲酸溶液与10ml0.1mol/L氢氧化钠溶液混合完全反应后溶液显碱性;
C、甲酸能与水以任意比混溶;
D、在相同条件下,甲酸溶液的导电性比同浓度的盐酸溶液的弱。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com