
题目列表(包括答案和解析)
27.(10分)有PH为13的Ba(OH)2、NaOH的混合溶液100mL,从中取出25mL用0.025mol/LH2SO4滴定,当滴定至沉淀不再增加时,所消耗的酸的体积是滴定至终点所耗酸体积的一半。求:
(1)当滴到沉淀不再增加时,溶液的PH(设体积可以加和)
(2)原混合溶液中Ba(OH)2和NaOH的物质的量浓度。
24.(12分)用酸碱中和滴定的方法测定NaOH和Na2CO3的混合液中的NaOH含量时,可先在混合液中加过量的BaCl2溶液,使Na2CO3完全变成BaCO3沉淀,然后用标准盐酸滴定(用酚酞用指示剂),试回答:
(1)向混有BaCO3沉淀的NaOH溶液中滴入盐酸,为什么不会使BaCO3沉淀溶解而能测定NaOH的含量?
。
(2)滴定时,若滴定管中滴定液一直下降到活塞处才达到滴定终点,则能否由此准确地计算出结果?
。
(3)能否改用甲基橙作指示剂? ,若用甲基橙作指示剂,则测定结果如何? 。
25实验室有一瓶混有氯化钠的氢氧化钠固体试剂,经测定NaOH的质量分数约为82.0%,为了验证其纯度,用浓度为0.2mol/L的盐酸进行滴定,试回答下列问题:
(1)托盘天平称量5.0g固体试剂,用蒸馏水溶解于烧杯中,并振荡,然后立即直接转入 500mL容量瓶中,恰好至刻度线,配成待测液备用。请改正以上操作中出现的五处错误。
(2)将标准盐酸装在25.00mL 滴定管中,调节液面位置在 处,并记下刻度。
(3)取20.00mL待测液,待测定。该项实验操作的主要仪器 有。用 试剂作指示剂时,滴定到溶液颜色由 刚好至 色时为止。
(4)滴定达终点后,记下盐酸用去20.00mL,计算NaOH的质量分数为 。
(5)试分析滚蛋定误差可能由下列哪些实验操作引起的 。
A、转移待测液至容量瓶时,末洗涤烧杯
B、酸式滴定管用蒸馏水洗涤后,直接装盐酸
C、滴定时,反应容器摇动太激烈,有少量液体溅出
D、滴定到终点时,滴定管尖嘴悬有液滴
E、读滴定管开始时仰视,读终点时俯视
26朱经武教授等人发现的高温超导材料YBa2Cu3O7-x,其零电阻转变温度Tw=90K。YBa2Cu3O7-x中x的值与TW有一定的关系,x值介于0.00-0.50之间,一般x的值越接近于零,Tw就越高。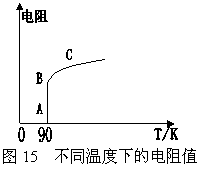 在YBa2Cu3O7-x中,Y、Ba、O都有固定的化合价,分别为+3、+2、-2;而Cu有+2、+3价的混合情况。可用碘量法测定Cu的量继而求得x的值。碘量法是氧化还原滴定法的一种,通常用标准碘溶液直接滴定还原性物质,也可根据某些氧化性物质在酸性溶液中与I-作用生成单质碘的性质,用标准还原剂Na2S2O3溶液滴定生成的碘单质,间接计算该氧化性物质的含量。在滴定过程中,S2O32-转化为S4O62-,Cu2+、Cu3+均被还原为CuI。
在YBa2Cu3O7-x中,Y、Ba、O都有固定的化合价,分别为+3、+2、-2;而Cu有+2、+3价的混合情况。可用碘量法测定Cu的量继而求得x的值。碘量法是氧化还原滴定法的一种,通常用标准碘溶液直接滴定还原性物质,也可根据某些氧化性物质在酸性溶液中与I-作用生成单质碘的性质,用标准还原剂Na2S2O3溶液滴定生成的碘单质,间接计算该氧化性物质的含量。在滴定过程中,S2O32-转化为S4O62-,Cu2+、Cu3+均被还原为CuI。
现取4.00×10-2gYBa2Cu3O7-x样品,用稀盐酸溶解,在氩气保护下加入1.00gKI 固体充分反应,Cu2+、Cu3+均转化为CuI,用0.0100mol/LNa2S2O3溶液滴定反应生成的I2,在滴定终点时消耗0.0100mol/LNa2S2O3溶液18.14mL。填空并回答:
(1)盛装Na2S2O3溶液进行滴定的仪器是 ,该实验选用的指示剂为 ,到达滴定终点的现象是 。
(2)写出滴定过程中S2O32-转化为S4O62-的离子方程式:
(3)求出所用样品中x的值: x= 。
(4)根据题给YBa2Cu3O7-x的电阻与温度关系的R-T图示说明曲线中AB、BC段的物理意义。
23.(4分)用相同浓度的盐酸中和体积相同的三种溶液至中性:a.Ba(OH)2、b.NaOH、c.NH3·H2O(以下盐酸的体积分别用VA、VB、Vc表示)
(1)若A、B、c物质的量浓度相同,所消耗盐酸体积关系为 。
(2)若A、B、c溶液的pH相同,所消耗盐酸体积关系为 。
22.(11分)25℃时,若体积为VA、pH=a的某一元强酸与体积VB、pH=b的某一元强碱混合,恰好中和,且已知Va<Vb和a=0.5b,请填写下列空白;
(1)a值可否等于3(填“可”或“否”)_________,其理由是
____________________________________________;
(2)a值可否等于5(填“可”或“否”)________,其理由是
_____________________________________________;
(3)a的取值范围是_______________________________________。
21.(3分)某学生中和滴定实验的过程如下:(1)取一支碱式滴定管;(2)用蒸馏水洗净;(3)即加入待测的NaOH溶液;(4)记录液面刻度读数;(5)用酸式滴定管精确放出一定量标准酸液;(6)置于未经标准酸液润洗的洁净的锥形瓶中;(7)加入适量蒸馏水;(8)加入酚酞试液两滴;(9)滴定时,边滴边振荡;(10)边注视滴定管内液面的变化;(11)当小心滴到溶液由无色变为粉红色时,即停止滴定;(12)记录液面刻度读数;(13)根据滴定管的两次读数得出NaOH溶液体积为22mL,指出上述实验过程中错误之处(用序号表示) 。
20.用0.01mol/LH2SO4滴定0.01mol/LNaOH溶液,中和后加水至100mL。若滴定时终点判断有误差:①多加了1滴H2SO4;②少加了1滴H2SO4(设1滴为0.05mL)。则①和②中c(H+)之比是 ( )
A.5×103 B.104 C.50 D.10
19.室温时某强酸溶液和某强碱溶液等体积混合后,所得溶液的PH为7。下列说法中正确的是 ( )
A.原有的酸溶液和碱溶液的物质的量浓度一定相等
B.如果生成盐的水溶液为碱性,则酸的浓度大于碱
C.原有酸、碱溶液的物质的量浓度没有确定关系
D.原有碱溶液的物质的量浓度更大。
18.实验室用标准盐酸溶液测定某NaOH溶液的浓度,用甲基橙作指示剂,下列操作中可能使测定结果偏低的是 ( )
A.酸式滴定管在装酸液前未用标准盐酸溶液润洗2~3次
B.开始实验时酸式滴定管尖嘴部分有气泡,在滴定过程中气泡消失
C.锥形瓶内溶液颜色变化由黄色变橙色,立即记下滴定管液面所在刻度
D.盛NaOH溶液的锥形瓶滴定前用NaOH溶液润洗2~3次
17.一种一元强酸HA溶液中加入一种碱MOH反应后,溶液呈中性,下列判断中正确的是 ( )
A.加入的碱过量 B.混合前酸与碱中溶质的物质的量相等
C.生成的盐不发生水解 D.反应溶液中c(A-)、c(M+)相等
16.将PH=3的盐酸与PH=11的氨水等体积混合后,溶液中离子浓度关系正确的是( )
A.c(NH4+)>c(Cl-)>c(H+)>c(OH-) B.c(Cl-)>c(NH4+)>c(H+)>c(OH-)
C.c(NH4+)>c(Cl-)>c(OH-)>c(H+) D.c(Cl-)>c(NH4+)>c(OH-)>c(H+)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com