
题目列表(包括答案和解析)
20.(14分)下面是某化学学习小组的同学进行研究性学习的过程,请你参与并协助他们完成相关学习任务。
[研究课题] 探究草酸晶体受热分解的产物
[查阅资料] 该小组同学通过网络查询,获得草酸及草酸晶体的-些相关知识:
|
名称 |
分子式 |
颜色、状态 |
溶解性 |
熔点(℃) |
|
草酸 |
H2C2O4 |
- |
易溶于水 |
189.5 |
|
草酸晶体 |
H2C2O4·2H2O |
无色晶体 |
- |
101.5 |
备注:草酸晶体失去结晶水后,175℃以上开始分解。
[提出猜想] (1)
 (2)分解产物中气体可能是CO、CO2或它们的混合物。
(2)分解产物中气体可能是CO、CO2或它们的混合物。
[设计方案] (1)请设计完成“猜想(1)”的实验方案[用简要的实验装置图表示,要体现所使用仪器(加热和夹持仪器不必画出)和试剂]
(2)化学学习小组的同学继续利用下图所示装置进行“猜想(2)”的实验探究。已知:A、C、F中盛装澄清石灰水,B中盛装浓NaOH溶液,D中装有碱石灰,E中装有CuO。
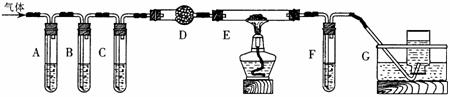
①证明分解产物中有CO2的现象是 ;
证明分解产物中有CO的现象是 。
②若未连接装置C,要达到同样的目的,可采取的措施是 。
[交流讨论] 小李同学继续查阅相关资料发现:草酸为二元弱酸,酸性比碳酸强,在受热分解过程中有少量升华;草酸钙和草酸氢钙均为白色不溶物。小李进一步研究,对实验中CO2的检验方案提出质疑。试根据相关信息,指出原设计中存在的问题,并提出实验的改进措施。
 。
。
19.(8分)某未知溶液X中可能含有K+、Fe2+、NH4+、Cl-。检验其中是否含有K+,通常有如下两套实验方案。
方案一:焰色反应法
用洁净的玻璃棒蘸取未知液X置于酒精灯外焰上灼烧,观察到火焰呈黄色,则证明其中不含K+。对上述实验过程中的错误和疏漏加以纠正、补充:
方案二:亚硝酸钴钠法
在CH3COOH酸化的溶液中,K+与亚硝酸钴钠[Na3Co(NO2)6]反应生成黄色沉淀[K2NaCo(NO2)6],该原理可用于K+的检验。(注意:NH4+也能与亚硝酸钴钠反应生成黄色沉淀,会干扰K+的检验。)
请你利用上述反应原理设计一个实验方案,检验未知溶液X中是否含有K+。
18.一定条件下CuS与稀HNO3发生反应,所得还原产物为NO,氧化产物为SO42-。现将0.06 mol CuS加入到50mL 4.2mol/LHNO3中,充分反应之后,忽略溶液体积变化,下列说法正确的是
A.被还原的硝酸为0.16 mol B.反应后溶液中仍有硝酸剩余
C.反应后溶液的pH=l D.CuS未全部参加反应
第二卷(非选择题 共76分)
17.某新型二次锂离子电池结构如图,电池内部是固体电解质,充电、放电时允许Li+在其间通过(电 池内部“→”表示放电时Li+的迁移方向)。充电、放电时总反应可表示为:
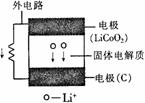 下列说法正确的是
下列说法正确的是
A.外电路上的“→”,表示放电时的电流方向
B.充电时阴极电极反应:LixC6-xe-=6C+xLi+
C.放电时负极电极反应:LiCoO2-xe-=Li1-xCoO2+xLi+
D.外电路有0.1 mole-通过,发生迁移的Li+的质量为0.7 g
16.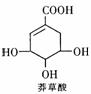
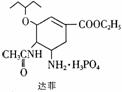 2005年禽流感在全球蔓延,百姓谈“禽”色变。目前通过从香料八角中提取的莽草酸制得的达菲是抗禽流感病毒特效药物。下列有关描述正确的是
2005年禽流感在全球蔓延,百姓谈“禽”色变。目前通过从香料八角中提取的莽草酸制得的达菲是抗禽流感病毒特效药物。下列有关描述正确的是
A.高温、紫外线都能使禽流感病毒失去生理活性
B.莽草酸既能与H2发生加成,又能与FeCl3溶液反应显紫色
C.莽草酸、达菲都能使溴水或酸性KMnO4溶液褪色
D.1mol达菲与NaOH溶液反应,消耗NaOH的物质的量最多为3mol
15.现有常温下的四份溶液:①0.01 mol/LCH3COOH;②0.01 mol/LHCl;③pH=12的氨水;
④pH=12的NaOH溶液。下列说法正确的是
A.①中水的电离程度最小,③中水的电离程度最大
B.将②、③混合,若有pH=7,则消耗溶液的体积:②>③
C.将四份溶液稀释相同倍数后,溶液的pH:③>④,②>①
D.将①、④混合,若有c(CH3COO-)>c(H+),则混合液一定呈碱性
14.C12、SO2均能使晶红溶液褪色,后者因为品红分子结构中的发色团遇到亚硫酸后结构发生改变, 生成不稳定的无色化合物,其漂白原理可用下面的反应方程式表示:
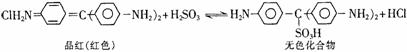
下列说法正确的是
A.品红溶液中同时通入C12、SO2,漂白效果会更好
B.加热可判断品红褪色是通入SO2还是通入C12引起的
C.“无色化合物”分子中,19个碳原子都可能在同一平面上
D.品红分子结构中,19个碳原子都可能在同一平面上
13.下列反应的离子方程式书写正确的是
A.实验室用大理石与醋酸反应制取二氧化碳:CaCO3+2H+=Ca2++CO2↑+H2O
B.向过氧化钠固体中滴加水:Na2O2+H2O=2Na++2OH-+O2↑
C.将溶质物质的量之比为4:3的NaHSO4和Ba(OH)2两溶液混合:
4H++3SO42-+3Ba2++4OH-=3BaSO4↓+4H2O
D.硫酸亚铁溶液中加入用硫酸酸化的过氧化氢溶液: Fe2++2H++H2O2=Fe3++2H2O
11.X+、Y+、M2+、N2-均为含有一定数目电子的短周期元素的简单离子,离子半径大小关系是:
N2->Y+、Y+> X+、Y+> M2+,下列说法正确的是
A.原子半径:N可能比Y大,也可能比Y小 B.M2+、N2-核外电子数:可能相等,也可能不等
C.原子序数:N>M>X>Y D.碱性:M(OH)2>YOH
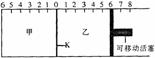 12.如图所示,甲、乙之间的隔板K可以左右移动,甲中充入2molA和1 molB,乙中充入2molC和 1molHe,此时,K停在0处。在一定条件下发生可逆反应:2A(g)+B(g)
12.如图所示,甲、乙之间的隔板K可以左右移动,甲中充入2molA和1 molB,乙中充入2molC和 1molHe,此时,K停在0处。在一定条件下发生可逆反应:2A(g)+B(g) 2C(g),反应达到平衡后,再恢复到反应发生前的温度。下列说法不正确的是
2C(g),反应达到平衡后,再恢复到反应发生前的温度。下列说法不正确的是
A.根据隔板K滑动与否可判断甲、乙中的反应是否达到了平衡
B.到达平衡后,隔板K最终停留在左侧刻度0-2之间
C.到达平衡时,最终甲容器中C的物质的量大于乙容器中C的物质的量
D.若平衡后隔板K停留在左侧1处,则活塞仍停留在右侧6处
10.下列实验操作的先后顺序合理的是
A.制取乙酸乙酯,应先将乙醇、乙酸混合,后加入到浓硫酸中
B.酸碱中和滴定中,应先将锥形瓶用待测液润洗,后加入一定体积的待测液
C.配制SnCl2溶液时,应先将SnCl2固体溶于浓盐酸中,后加水稀释
D.用分液漏斗滴液,应先旋开分液漏斗的活塞,后打开漏斗上口的玻璃塞
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com