
题目列表(包括答案和解析)
19.(12分)如下图,已知X为中学化学中的一种常见的盐,F为淡黄色固体;M、N为常见的金属,N的最高价氧化物是耐火材料,它的晶体硬度很大,常做手表的轴承;H为单质。下图中部分反应产物已略去。
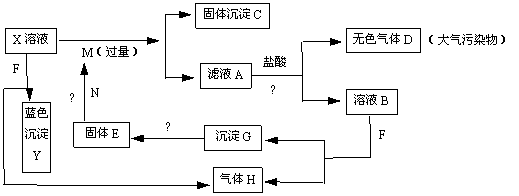
(1)X的化学式为 ;F的电子式为 。
(2)反应①的离子方程式为_______________________________________________。
反应②的化学方程式为_______________________________________________。
(3)若向100 mL 盐X的溶液中加入10 g金属单质M的粉末,充分搅拌后,过滤,烘干得10.16g固体C。则滤液A中溶质的物质的量浓度为________________________。
18.(8分)A、B、C、D是四种短周期元素,它们的原子序数依次增大,其中A、C及B、D分别是同一主族元素,B、D元素的原子核中质子数之和是A、C两元素原子核中质子数之和的两倍,又知四种元素的单质中有两种气体、两种固体。请回答:
⑴C、D组成的常见化合物,其水溶液呈碱性,原因是 ____________(用离子方程式表示)。写出两种均含A、B、C、D四种元素的化合物相互间发生反应,且生成气体的离子方程式 ___________。
⑵D的单质能跟C的最高价氧化物水化物的浓溶液发生氧化还原反应,生成的两种正盐的水溶液均呈碱性,写出该氧化还原反应的离子方程式: _______________。
⑶A、B、D间可形成甲、乙两种微粒,它们均为负一价双原子阴离子且甲有18个电子,乙有10个电子,则甲与乙反应的离子方程式为 。
17.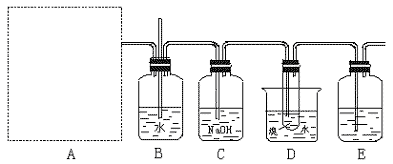 (11分)实验:下图为实验室用乙烯与液溴作用制取1,2-二溴乙烷的部分装置图,
(11分)实验:下图为实验室用乙烯与液溴作用制取1,2-二溴乙烷的部分装置图,
1,2-二溴乙烷的主要物理性质是
|
熔点 |
沸点 |
密度 |
溶解性 |
|
9.79℃ |
131.4℃ |
2.18g·cm-3 |
难溶于水易溶于醇醚等 |
(1)试在方框内画出乙烯的发生装置图。
(2)B、D中都盛有水,这两个装置的作用分别是 、
。
(3)C和E装置都盛有NaOH溶液,它们的作用是
(4)写出以乙醇、浓硫酸、液溴为主要原料生成1,2-二溴乙烷的主要化学反应方程式 。
16.(9分)某化学课外小组用海带为原料制取了少量碘水。现用CCl4从碘水中萃取碘,并用分液漏斗分离两种溶液.其实验操作可分解为如下几步:
(A)把盛有溶液的分液漏斗放在铁架台的铁圈中;
(B)把50毫升碘水和15毫升CCl4加入分液漏斗中,并盖好玻璃塞;
(C)检验分液漏斗活塞和上口的玻璃塞是否漏液;
(D)倒置漏斗用力振荡,并不时旋开活塞放气,最后关闭活塞,把分液漏斗放正;
(E)旋开活塞,用烧怀接收溶液;
(F)从分液漏斗上口倒出上层水溶液;
(G)将漏斗上口的玻璃塞打开或使塞上的凹槽或小孔对准漏斗口上的小孔;
(H)静置,分层.
就此实验,完成下列填空:
(1)正确操作步骤的顺序是:(用上述各操的编号字母填写)
→ → → → → → →
(2)上述(E)步骤的操作中应注意
上述(G)步骤操作的目的是
(3)能选用CCl4从碘水中萃取碘的原因是
(4)下列物质,不能作为从溴水中萃取溴的溶剂的是
(A)热裂汽油 (B)苯 (C)酒精 (D)正庚烷
14、下列各溶液中,微粒的物质的量浓度关系正确的是 ( )
A 、0.1mol·L-1的(NH4)2SO4溶液中:c(SO42-)>c(NH4+)>c(H+)>c (OH-) B 、0.2mol·L-1的Na2CO3溶液中:c(OH-)=c(HCO3-)+c(H+)+c(H2CO3) C 、0.1mol·L-1的NH4Cl溶液与0.05mol·L-1的NaOH溶液等体积混合,
c(Cl-)>c(Na+)>c(NH4+)>c(OH-)>c(H+)
D 、c(NH4+)相等的(NH4)2SO4溶液,(NH4)2CO3溶液和NH4Cl溶液,
c[(NH4)2SO4]<c[(NH4)2CO3]<c( NH4Cl)
15、铁粉和铜粉的均匀混合物,平均分成四等份,分别加入同浓度的稀硝酸,充分反应,在标准状况下生成NO的体积和剩余金属的质量如下表(设硝酸的还原产物只有NO):
|
编号 |
① |
② |
③ |
④ |
|
稀硝酸体积/mL |
100 |
200 |
300 |
400 |
|
剩余金属/g |
18.0 |
9.6 |
0 |
0 |
|
NO体积/mL |
2240 |
4480 |
6720 |
V |
下列计算结果正确的是
A. ①中溶解了5.6gFe B.硝酸的浓度为4mol/L
C. ②中溶解了9.6gCu D.④中V=8960
第Ⅱ卷(非选择题 共90分)
13、已知某些电解质分子的中心原子最外层电子未达饱和结构,其电离采取结合溶液中其它离子使中心原子最外层达到饱和结构的形式,如硼酸在水中可用方程式表示为:①H3BO3 + H2O 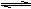 [B(OH)4]- + H+;②铍的化合物间可发生以下反应:BeCl2+Na2BeO2+2H2O=2NaCl+2Be(OH)2↓。则以下推断中正确的是( )
[B(OH)4]- + H+;②铍的化合物间可发生以下反应:BeCl2+Na2BeO2+2H2O=2NaCl+2Be(OH)2↓。则以下推断中正确的是( )
A 、BeCl2溶液pH<7,将其蒸干、灼烧后可得残留物BeCl2 B 、Na2BeO2溶液pH>7,将其蒸干、灼烧后可得残留物Na2BeO2 C 、Be(OH)2和B(OH)3均是两性氢氧化物,且硼酸可视为三元酸 D 、硼酸加入水中后可促进水的电离
12、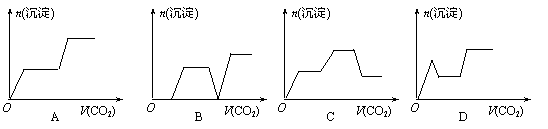 将足量的CO2不断通入KOH、Ba(OH)2、KAlO2的混合溶液中,生成沉淀与通入CO2的量的关系可表示为 ( )
将足量的CO2不断通入KOH、Ba(OH)2、KAlO2的混合溶液中,生成沉淀与通入CO2的量的关系可表示为 ( )
11、据世界卫生组织调查,缺铁性贫血是世界上最流行的营养性问题,一个简单的办法即是在普通酱油中加入无铁腥味、极易被人体吸收的添加剂--EDTAFeNa,其中EDTA结构(如下左图),酱油生产以后的废水可用物质绿色消毒剂(消毒后无公害)X(如下右图)来杀菌。
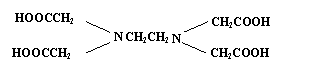
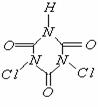
下列说法正确的是
A、1mol EDTA能与4mol NaOH发生反应
B、可用分液漏斗从铁强化酱油中分离出EDTAFeNa
C、EDTA和X在一定条件下均能发生水解反应
D、X起氧化杀菌作用的可能是其水解产物次氯酸
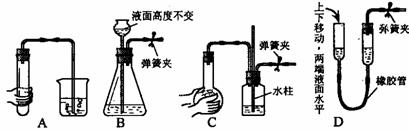
10、下列各图所示装置的气密性检查中,漏气的是
9.如右图所示,A池用石墨电极电解氢氧化钠溶液,B池精炼粗铜,一段时间后停止通
 电,A池D极产生的气体在标准状况下为2.24 L。下列说法正确的是
电,A池D极产生的气体在标准状况下为2.24 L。下列说法正确的是
A.A池为电解池,B池为原电池
B. D电极与E电极都发生氧化反应
C.F极是以粗铜板为材料作阳极
D.B池中E极质量增加25.6 g
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com