
题目列表(包括答案和解析)
4.下面的推断,错误的是 [ ]
A.铍是一种轻金属,它的氧化物的水化物可能具有两性
B.砹是一种有色固体,HAt很不稳定,AgAt是有色难溶于水且感光性很强的固体
C.硫酸锶(SrSO4)是难溶于水和盐酸的白色固体
D.硒化氢(H2Se)是无色、有毒,比H2S稳定的气体
3.第三周期元素R,它的最外层达到饱和时所需电子数小于次外层和最内层电子数之差,并且等于最内层电子数的正整数倍,则关于R的正确说法 [ ]
①常温下能稳定存在的R的氧化物都能与NaOH溶液反应;
②R的最高价氧化物对应水化物都是强酸;
③R的单质固态时属于同一类型的晶体;
④R 的气态氢化物都能受热分解。
A.仅①
B.①②④
C.①④
D.②③④
2.第二周期的元素与氢元素所形成的常见分子或离子中,电子总数为10的有 [ ]
A.6种以上
B.5种
C.4种
D.3种
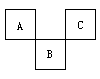
1.短周期元素X、Y、Z在周期表中的位置关系如右图,其中正确的是 [ ]
A.Z一定是活泼金属元素
B.X的最高价氧化物的水化物是一种强酸
C. 1molY 的单质跟足量水反应时,发生转移的电子为2mol
D.由Z单质形成的晶体属于分子晶体

[引入]元素周期律揭示了元素之间的内在联系,元素周期表是元素周期律的具体体现形式。那么,这种元素间的内在联系表现在哪些方面?这些规律对于我们解决实际问题又有哪些具体的指导意义呢?
请同学们谈谈自己的体会和看法。
倾听,思考。
积极参加讨论,并发言。
思考,发言:
(1)原子序数=核电荷数=质子数=核外电子总数;
(2)由核外电子总数可知电子的排布,从而知道电子层数,推知该元素在周期表中的周期数;
(3)最外层电子数决定元素的化学性质;
(4)根据元素在周期表中的位置,可推知元素的化学性质。
[评价]只知道周期数,能否确定元素在周期表中的位置?对,还得知道它所在的族序数。
[评价]元素的化学性质难道只与最外层电子数有关吗?对,还与原子半径即电子层数的多少有关。
教师活动
[投影]现在我们来系统地归纳“位-构-性”三者之间的关系:元素“位-构-性”三者之间的关系小结:

[过渡]现在我们来看例题:
[投影]例7 下图是周期表中短周期的一部分,A、B、C三种元素原子核外电子数之和等于B的质量数。B原子核内质子数和中子数相等。下面叙述中不正确的是 [ ]
A.三种元素的原子半径的大小顺序是B<A<C
B.A元素最高价氧化物的对应水化物具有强氧化性和不稳定性
C.B元素的氧化物,氢化物的水溶液都呈酸性
D.C元素的单质是非金属单质中唯一能跟水激烈反应的单质
[提问]我们请一位同学示范讲解本题的分析及推断过程。其他同学注意思考,有欠缺的地方予以补充。
读题,思考并回答:
(1)由于 A、B、C是短周期元素,它们在表中的位置关系明确,因此,可设B的原子序数是x,则A的原子序数是(x-9),C原子序数是(x-7);
(2)又由于 A、B、C三种元素原子核外电子数之和等于B的质量数,B原子核内质子数和中子数相等,则有等式:
(x-9)+x+(x-7)=2x,则有x=16。
可知B为16号S元素,则A为N元素,C为F元素。
(3)据上述分析得:只有A不正确。</PGN0051.TXT/PGN>
[投影]例8 在周期表主族元素中,甲元素与乙、丙、丁三元素上下或左右紧密相邻。甲、乙两元素的原子序数之和等于丙元素的原子序数。这四种元素原子的最外层电子数之和为20。据此可以判断:元素甲为______,元素丙为______,元素乙和丁所形成化合物的分子式为______或______。
[组织讨论]请讨论解题思路并求解。
读题,分析及解答:
依据元素周期表中元素位-构-性三者之间的关系,利用题给信息,确定突破口:
(1)可以最外层电子数之和为20猜想,甲的最外层电子数在5左右;
(2)可以甲元素与乙、丙、丁三元素上下或左右紧密相邻,写出四种可能的位置关系,设出甲的序数,结合最外层电子数之和为20求解。
答案:甲为N,丙为P,乙和丁的化合物为CO或CO2。
[课堂小结]
精选题
[投影]
例题1如图2-17,E为沾有Na2SO4溶液的滤纸,并加入几滴酚酞。A,B分别为Pt片,压在滤纸两端,R、S为电池的电极。M、N是用多微孔的Ni的电极材料,它在碱溶液中可以视为惰性电极。G为电流计,K为开关。C、D和电解池中都充满浓KOH溶液。若在滤纸中央点上一滴紫色的KMnO4溶液,K打开,接通电源一段时间后,C、D中有气体产生。
(1)外电源的正、负极分别是R为____,S为_____。
(2)A附近溶液的现象是_______,B附近发生的电极反应式为_____。
(3)滤纸上的紫色点向哪方移动____。
(4)当C、D里的气体产生到一定量时,切断外电源并接通开关K,经过一段时间,C、D中气体逐渐减少,主要因为____,有关的反应式为_____。
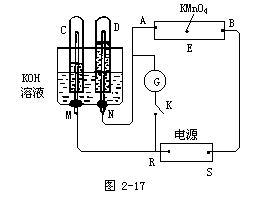
根据图分析回答:
(1)C、D产生气体的体积是不相同的,由此可以判断C端的气体是氢气,D端产生的气体是氧气,所以确定R为负极而S端是正极。
(2)A附近的变化是变为红色,因为D端放氧气,N端为阳极,而A端为阴极,吸引阳离子,阳离子放电2H+-2e=H2。因为,电解破坏了水的电离平衡,所以,此处OH-浓度增大,溶液显红色。而在B端发生OH-放电,其反应为:4OH--4e=2H2O+O2。
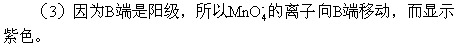
(4)氢气和氧气在碱的环境下发生的是电池反应,(类似燃烧电池),消耗了氢气和氧气。
(-)2H2+4OH--4e=4H2O
(+)O2+2H2O+4e=4OH-
[评价]此题是一道比较综合的题,它考察了电化学知识的大部分内容。
此题的突破点是,示意图中的两种气体的体积,由此确定电源的正、负极,使题中所有问题迎刃而解。这位同学分析得非常好,我们应该认真的读题,抓住题中的突破口。
[投影]
例题2 用石墨电极电解100mLH2SO4和CuSO4混合溶液,通电一段时间后,两极各出现气体2.24L(标准状况),求原来溶液中CuSO4的浓度。
请同学们分析后给出答案。
回答:
阳极产生的氧气为2.24L,阴极产生的氢气为2.24L。
由CuSO4电解时放出的氧气为0.05mol,计算是:
2Cu2+-O2
2/y=1/0.05 y=0.1mol
c(Cu2+)=0.1/0.1=(mol/L)
[评价]
此题的突破口是根据题意分析出两极各产生的气体为2.24L;根据得失电子守恒。
同学们的分析是非常正确的。
[投影]
例题3 人工生成铝表面的氧化铝保护膜的方法是将表面光洁的铝制品作为阳极放入盛18%H2SO4溶液的电解槽。通电一定时间,设阳极氧气全部与铝反应。
思考后回答:
通过的电量为1A×3600s=3600C(库仑)。由3600C/96500C/mol等于0.037mol的电子。
今有表面积约1.0dm2的铝制品,放入电解槽,通入1A的电流1h(小时),已知氧化铝膜的密度为2.67g/cm3,则生成均匀的氧化膜的厚度是多少?
请同学们分析:
在从2molAl与1.5mol氧气反应产生氧化铝可知,得失电子为6mol。根据此反应计算出氧化铝的物质的量,再根据氧化铝的密度和表面求出氧化膜的厚度。
此题的答案是:24μm(微米)。
[评价]
3.综合利用--实用电池与可逆电池
常见的电池应用是:
①干电池(Zn-Mn电池)
日常生活和照明。
②铅蓄电池
应用于国防、科技、交通、化学电源等。
③锂电池
密度小,寿命长应用于电脑、手表、心脏起搏器、火箭、导弹的电源。
④燃烧电池
污染小、能量转化高,应用于高科技研究。
⑤其它电池
铝电池:能量高、不污染环境应用于照明、野营作业。
回答:
应用在手电、心脏起搏器、海洋照明、航标电源。
今后我们还可以根据原理设计出更多更好的实用电池。
2.电解规律的应用
[设问]
电解规律的应用有什么内容?
回答:
主要应用是:依据电解的基本原理分析判断电解质溶液。
[设问]
如何恢复电解液的浓度呢?(举例说明)
回答:
电解液应先看pH的变化,再看电极产物。欲使电解液恢复一般是:
电解出什么物质就应该加入什么,如:电解饱和食盐水在溶液中减少的是氯气和氢气,所以应该加入的是氯化氢。</PGN0101.TXT/PGN>
[设问]
如果电解硫酸铜时,要恢复原来的浓度应该加入什么呢?
回答:
因为电解硫酸铜时,生成的是铜和氧气,所以应该向溶液中加入氧化铜。
[设问]
电解在应用中还应该注意什么呢?
回答:
在分析应用问题中还应该注意:
一要:不仅考虑阴极、阳极放电的先后顺序,还应该注意电极材料(特别是阳极)的影响;二要:熟悉用惰性电极电解各类电解质溶液的规律。
[练习]
用石墨电极电解1mol/L的下列溶液,溶液的pH不变的是______。
(1)HCl (2)NaOH
(3)Na2SO4 (4)NaCl
回答:
盐酸溶液电解产生氯气和氢气,溶液的pH升高。
氢氧化钠溶液电解产生氢气和氧气,溶液的pH升高。
硫酸钠溶液电解产生氢气和氧气,溶液的pH不变。
氯化钠溶液电解产生氢氧化钠、氢气和氯气,溶液的pH升高。
所以(1)、(2)、(4)溶液的pH都增大。
答案:pH不变的是(3)。
以上的四种溶液电解后,如何使其浓度恢复到原来的浓度呢?
回答:
在(1)中应该加入氯化氢。
在(2)中应该加入一定量的水。
在(3)中应该加入一定量的水。
在(4)中应该加入一定量的氯化氢。
1.下列五个烧杯中均有天然水
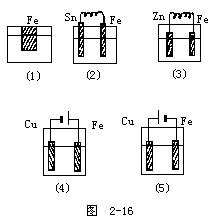
铁被腐蚀由快到慢的顺序是:______。
回答:
从图和复习归纳的方法可以分析,有外接电源时铁放在电源的正极,铁被腐蚀的最快;若放在负极腐蚀的最慢;原电池中,两极的金属活动性差别越大,反应越快,但若有活动性强于铁的金属存在则铁不被腐蚀(保护了铁),所以此题的答案是:
(4)、(2)、(1)、(3)、(5)。
1.原电池原理的应用
[设问]
请同学们根据已经复习的知识回答原电池原理的应用及依据?
回答:
应用到实际中有:
(1)由电极反应现象确定原电池的正极和负极,用来判断电极金属活动性强弱。
(2)分析判断金属腐蚀的快慢程度。
(3)由电池反应分析判断新的化学能源的变化,判断放电、充电。
[投影]
[评价]学生总结的很好,看以下归纳。
根据学生的回答小结:
原电池原理的三个应用和依据:
(1)电极反应现象判断正极和负极,以确定金属的活动性。其依据是:原电池的正极上现象是:有气体产生,电极质量不变或增加;负极上的现象是:电极不断溶解,质量减少。
(2)分析判断金属腐蚀的速率,分析判断的依据,对某一个指定金属其腐蚀快慢顺序是:
作电解池的阳极>作原电池的负极>非电池中的该金属>作原电池的正极>作电解池的阴极。
判断依据:
(1)根据反应现象原电池中溶解的一方为负极,金属活动性强。
(2)根据反应的速度判断强弱。
(3)根据反应的条件判断强弱。</PGN0100.TXT/PGN>
(3)由电池反应分析判断新的化学能源的变化,分析的思路是先分析电池反应有关物质化合价的变化,确定原电池的正极和负极,然后根据两极的变化分析其它指定物质的变化。
[练习]
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com