
题目列表(包括答案和解析)
11.(06年江苏淮阴)据《参考消息》报道,有科学家提出硅是“21世纪的能源”、“未来的石油”的观点。假如硅作为一种普遍使用的新型能源被开发利用,关于其有利因素的下列说法中,你认为不妥当的是
A.硅便于运输、贮存,从安全角度考虑,硅是最佳的燃料
B.硅的来源丰富,易于开采,且可再生
C.硅燃烧放出的热量大,且燃烧产物对环境污染程度低,容易有效控制
D.寻找高效新催化剂,使硅的生产耗能很低,是硅能源开发利用的关键技术
答案:D。
解析:A项,硅是固体,从安全角度考虑,不必考虑泄露的问题,便于运输、贮存,说法正确;B项,硅元素在自然界中的含量居第二位,来源丰富,说法也对:C项,硅燃烧,生成的二氧化硅是固体,说法也对;D项,理论上,制备硅不需要催化剂,说法不对。
评价:此题旨在讨论硅作新型燃料的特点和硅能源开发利用的优势,属于容易题。
6.(06年湖南石门)在下列各说法中,正确的是
A.△H > 0表示放热反应,△H < 0表示吸热反应
B.热化学方程式中的化学计量数只表示物质的量,可以是分数
C.1 mol H2SO4与1 mol Ba(OH)2反应生成BaSO4沉淀时放出的热叫做中和热
D.1 mol H2与0.5 mol O2反应放出的热就是H2的燃烧热
答案:B。
解析:A项,△H > 0表示吸热反应,△H < 0表示放热反应;C项,“中和热”是指在稀溶液中,酸和碱发生中和反应,生成1 mol水时放出的热量。1 mol H2SO4与1 mol Ba(OH)2反应生成2 mol水,放出的热大于中和热;D项,在101 kPa时,1 mol H2与0.5 mol O2反应,生成液态水时放出的热才是H2的燃烧热;题中没有说明生成的水的聚集状态,不行。
评价:此题旨在考查对“热化学方程式的意义”的理解和对“中和热”、“燃烧热”概念的掌握,属于中等偏易题。
4.(06年天津)已知:H+ (aq)+OH- (aq)= H2O △H1 = - 57.3 kJ·mol-1,
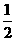 H2SO4(浓)+ NaOH(aq)=
H2SO4(浓)+ NaOH(aq)=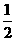 Na2SO4(aq)+ H2O(l) △H2 = m,下列说法正确的是( )
Na2SO4(aq)+ H2O(l) △H2 = m,下列说法正确的是( )
A.上述热化学方程式中的计量数表示分子个数 B. △H1>△H2
C.△H2 = - 57.3 kJ·mol-1 D. |△H1|>|△H2|
答案:B。
解析:热化学方程式中的化学计量数表示物质的量,A项不对;浓H2SO4在稀释时放热,含0.5 mol H2SO4的浓H2SO4与1 mol NaOH反应放出的热量应等于浓硫酸稀释时放出的热量和中和热之和,因此,△H2 < △H1 < 0,且|△H1| > |△H2|。
评价:此题旨在考查对“热化学方程式的意义”的理解和对“中和热”概念的掌握,属于容易题。
4.(06年湖南简阳)已知H+(aq) + OH-(aq) = H2O(l) ΔH = - 57.3 kJ·mol-1。以下四个化学反应方程式:
① H2SO4(aq) +2 NaOH(aq) = Na2SO4(aq) + 2 H2O(l);
② H2SO4(aq) + Ba(OH)2(aq) = BaSO4(s) + 2 H2O(l);
③ HCl(aq) + NH3•H2O(aq) = NH4Cl(aq) + H2O(l);
④ CH3COOH(aq) + NH3•H2O(aq) = CH3COONH4(aq) + H2O(l)。
其中反应热为57.3 kJ·mol-1的是( )
A.①和② B.③ C.④ D.以上都不对
答案:D。
解析:此题与“中和热”概念有关,“中和热”是指在稀溶液中,酸和碱发生中和反应,生成1 mol水时放出的热量。H+(aq) + OH-(aq) = H2O(l) ΔH = - 57.3 kJ·mol-1表示强酸和强碱反应时的中和热。反应①、②中,都生成2 mol水, 反应热一定大于57.3 kJ·mol-1;③中NH3•H2O是弱碱,电离时吸热,HCl和NH3•H2O反应的中和热小于57.3 kJ·mol-1;④中CH3COOH是弱酸,NH3•H2O是弱碱,电离时吸热,CH3COOH和NH3•H2O反应的中和热小于57.3 kJ·mol-1,因此①、②、③、④都不对。
评价:此题旨在考查对“中和热”概念的理解和判断,属于容易题。
3.(06年重庆)下列热化学方程式中的ΔH能表示物质燃烧热的是( )
A. 2 CO(g) + O2(g) = 2 CO2(g) ΔH = - 566 KJ·mol-1
B. CH4(g) + 2 O2(g) = CO2(g) + 2 H2O(l) ΔH = - 890 KJ·mol-1
C. 2 H2(g) + O2(g) = 2 H2O(l) ΔH = - 571.6 KJ·mol-1
D. H2(g) + Cl2(g) = 2 HCl(g) ΔH = - 184.6 KJ·mol-1
答案:B。
解析:“燃烧热”的定义是:在101 kPa时,1 mol物质完全燃烧生成稳定的氧化物时放出的能量;热化学方程式中的化学计量数表示物质的量。A、C项中CO、H2的物质的量是2 mol,不行;D项H2不是在氧气中燃烧,不符合燃烧热的定义。
评价:此题旨在考查对“燃烧热”概念的理解,属于容易题。
2.(06年南师大附中)“摇摇冰”是一种即用即冷的饮料。吸食时将饮料罐隔离层中的化学物质和水混合后摇动即能制冷。该化学物质是( )
A.氯化钠 B.生石灰 C.氢氧化钠 D.硝酸铵
答案:D。
解析:将该物质和水混合后摇动即能制冷,说明此物质溶于水时,可以吸收大量的热。四个选项中,氯化钠溶解时没有明显的放热或吸热现象;生石灰和氢氧化钠溶解时均能放出大量的热;只有硝酸铵溶解时,吸收大量的热,能起到致冷作用。
评价:此题旨在考查对“溶质在水中溶解时的热量变化”的认识,属于容易题。
1.(06年浙江湖州)下列各图中,表示正反应是吸热反应的是( )
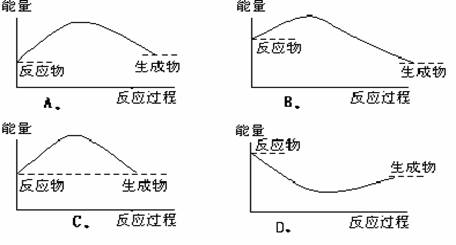
答案:A。
解析:吸热反应是由于反应物所具有的总能量低于生成物所具有的总能量,从图象来看,符合题意的只有A。
评价:此题旨在考查对“吸热反应”概念的掌握和图象识别能力,属于容易题。
7. C4H10(g)+13/2O2(g)=4CO2(g)+5H2O(g); ΔH= -2900 kJ·mol-1
2900; -2680
6. H2(g)+1/2O2=H2O(g); ΔH= -241.8 kJ·mol-1
-285.8; 285.8
8.(1)C6H12O6(s)+6O2(g)===6CO2(g)+6H2O(l); ΔH= -2800 kJ·mol-1
(2) 2800 kJ·mol-1×100g/180g·mol-1=1556 kJ
课后练习:
|
1B |
2D |
3D |
4D |
5A |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com