
题目列表(包括答案和解析)
21、⑴ 原子 ⑵放出 ⑶462 每空2分,共6分。
20、⑴500mL容量瓶,胶头滴管。共2分。
⑵控制酸碱滴定管活塞;锥行瓶中溶液颜色变化,判断滴定终点。共4分。
⑶97.56﹪(或97.6﹪)。共2分。
⑷①偏低 ②正常 ③偏低 共3分。
19、A、E 共4分。漏选得2分,错选倒扣分,本题不出现负分。
26.(9分)用FeCl3溶液腐蚀敷有铜箔的绝缘板,可制成印刷线路板。发生的反应是:
2FeCl3 + Cu===2FeCl2 + CuCl2
现将一块敷有铜箔的绝缘板浸入200mL FeCl3溶液中,一段时间后取出,再加入铁粉A g(足量),充分反应后滤出固体,经洗涤,干燥后称量,残留固体质量为B g。再从滤液中取出20.00mL(上述有关反应不考虑溶液体积的变化),滴入0.60mol/L AgNO3溶液100mL,恰好将溶液中的氯离子沉淀完全。
求:⑴原FeCl3溶液的物质的量浓度。
⑵B的取值范围(用含A的代数式表示)。
⑶若A-B = 5.0,则线路板上被腐蚀的铜的质量。
2005年高三化学月考(II)试卷答案及评分标准
选择题(每题4分,17、18题各5分,共74分。有两个答案的漏选得2 分,错选不得分)
|
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
|
A |
C |
D |
D |
C |
D |
B |
C |
C、D |
|
10 |
11 |
12 |
13 |
14 |
15 |
16 |
17 |
18 |
|
A、B |
B |
B、C |
A |
A、D |
D |
B |
D |
A、B |
25.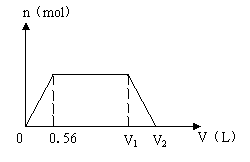 (8分)有一种含氢氧化钠和氢氧化钡的混和碱液的PH=14。取该溶液100mL,在标准状况下缓缓通入CO2(假设CO2发生反应时能被完全吸收),通入CO2气体的体积V(L)与生成沉淀的物质的量n(mol)之间的关系,符合下列图像:
(8分)有一种含氢氧化钠和氢氧化钡的混和碱液的PH=14。取该溶液100mL,在标准状况下缓缓通入CO2(假设CO2发生反应时能被完全吸收),通入CO2气体的体积V(L)与生成沉淀的物质的量n(mol)之间的关系,符合下列图像:
(1)求100mL混合碱液中含氢氧化钠的物质的量。
(2)求V1、V2的值。
24.(8分)据报道,最近摩托罗拉公司研发了一种由甲醇和氧气以及强碱作电解质溶液的新型手机电池,电量是现用镍氢电池和锂电池的十倍,可连续使用1个月才充电一次。假设放电过程中甲醇完全氧化产生的CO2被充分吸收生成CO32-。
(1)该电池总反应的离子方程式是
(2)甲醇在 极发生反应,其电极反应式是
(3)若用16g甲醇氧化产生的电能电解足量的CuSO4溶液,整个过程能量的利用率为80%,则电解时将产生标准状况下的气体 L。
23.(16分)消毒剂在日常生活、医疗、卫生、防疫中都有着重要作用。
⑴下列消毒剂的使用正确的是
A. 预防“非典”常使用过氧乙酸、“84”消毒液、漂粉精等消毒剂。
B. 医疗上常用无水酒精或含H2O2 3﹪的双氧水进行皮肤消毒。
C. 因患“禽流感”而被捕杀的家禽尸体常用生石灰处理。
D. 食品加工、消毒、防腐常使用福尔马林。
E. 在农业上,常用硫酸铜、石灰和水配制的悬浊液来消灭病虫害。
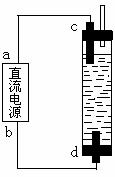 ⑵某学生制作了一种家用环保型消毒液发生器。装置如图所示:
⑵某学生制作了一种家用环保型消毒液发生器。装置如图所示:
用石墨作电极电解饱和食盐水,即可制得有较强杀菌能力的消毒液。请判断:在该装置中,b为电源的 极;
C电极上发生的电极反应式是
;
所得消毒液的主要成分是 。
⑶自来水厂常用液氯和绿矾(FeSO4•7H2O)进行消毒、净水。 绿矾所起的作用一是除去余氯;二是其氧化产物经水解后具有净水作用。请写出有关反应的离子方程式:
。
⑷现在一些大城市的自来水厂已经改用高铁酸钠(Na2FeO4)替代液氯和绿矾进行消毒净水。请简述高铁酸钠消毒、净水的原理:
。
22.(14分)氮可以形成多种离子,如N3-,NH2-,N3-,NH4+,N2H5+,N2H62+等,已知N2H5+与N2H62+离子的形成过程与NH4+形成过程相类似。
⑴液氨中存在着与水类似的自偶电离,产生的离子是 (填上述离子中的两种)。223K时,这两种离子浓度的乘积 1×10-14。(填“大于”、“小于”或“等于”)
⑵写出N2H5+的电子式 。
⑶写出N2H62+在足量强碱溶液中反应的离子方程式
。
⑷写出三种多原子组成的含有与N3- 电子数相同的微粒化学式 。
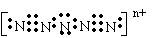 ⑸有一种离子化学式是:N5n+,电子式是
, 。
⑸有一种离子化学式是:N5n+,电子式是
, 。
其n的值是 ,该离子的空间构形是 。(A.直线型 B.“V”型
C.“W”型,用A、B、C填空)。
21.(6分)2004年7月,法俄两国科学家共同宣布,在高压下,氮气会聚合生成高聚氮。在这种高聚氮的晶体中,每个氮原子都通过三个单键与其它氮原子结合并向空间发展,构成立体网状结构。已知该晶体中N-N的键能为160KJ/mol,而氮气中N≡N的键能为942KJ/mol,(键能表示形成化学键释放的能量或破坏化学键消耗的能量)。
(1)高聚氮晶体属于___________晶体。
(2)高聚氮转化为氮气时,将_______(“吸收”或“放出”)能量,当生成1molN2时,能量变化是____________KJ。
20.(11分)用中和滴定法测定某烧碱的纯度。请根据要求回答问题:
(1)配制待测溶液。将准确称量的4.10g固体烧碱(含有少量中性易溶杂质),配制成500mL待测液。其操作过程需要用到烧杯、玻璃棒,还必须用到的仪器有__________________。
(2)用0.20mol/L的盐酸来滴定待测液。滴定操作过程中左手操作是_____________________。眼睛观察________________________________________。
(3)将三次滴定的数据处理得实验结果。三次滴定时每次都取用待测液20.00mL。三次耗用盐酸溶液分别为20.05mL、23.80mL、19.95mL。烧碱样品的纯度是________﹪。
(4)实验误差分析。(下列每格填“偏高”或“偏低”或“正常”)
①配制待测溶液时,溶液转移后,烧杯未洗涤。__________________
②滴定开始前,锥形瓶用蒸馏水洗净后未干燥。___________________
③滴定过程中,锥形瓶中有少量溶液溅出瓶外。__________________
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com