
题目列表(包括答案和解析)
24.(12分)在常温常压下,把a mol的NH3和O2的混合气充入密闭容器中,在催化剂存在下加热,使其充分反应,然后恢复到原来的温度和压强.
(1)写出容器内NH3被氧化和形成HNO3的化学方程式.
(2)若原混合气中O2的体积分数为x,最后在容器中生成的HNO3为ymol.
请填写下表.
|
x的取值范围 |
用x表示的y值表示式 |
|
|
|
|
|
|
|
|
|
23.(8分)将1.05g铝和过氧化钠的混合物放入一定量的水中,充分反应后固体无剩余。再向其中加 入50mL1mol·L-1的盐酸,可恰好使反应过程中产生的沉淀刚好消失。求原混合物中铝、过氧化钠各多少克?
22.(10分)有机化学反应因反应条件不同,可生成不同的有机产品。例如:
(1)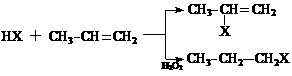 (X为卤素原子)
(X为卤素原子)
(2)苯的同系物与卤素单质混合,若在光照条件下,侧链上氢原子被卤素原子取代;若在催化剂作用下,苯环上的氢原子被卤素原子取代。
工业上利用上述信息,按下列路线合成结构简式为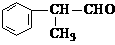 的物质,该物质是一种香料。
的物质,该物质是一种香料。
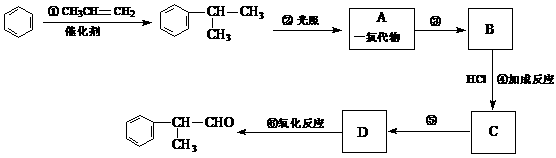 请根据上述路线,回答下列问题:
请根据上述路线,回答下列问题:
(1)A的结构简式可能为_______________和_____________________。
(2)反应①、③、⑤的反应类型分别为________、________、_______。
(3)反应④的化学方程式为(有机物写结构简式,并注明反应条件):
_________________________________________________________。
(4)这种香料具有多种同分异构体,其中某些物质有下列特征:①其水溶液遇FeCl3溶液呈紫色 ②分子中有苯环,且苯环上的一溴代物有两种。写出符合上述条件的物质可能的结构简式(只写两种):
____________________________________________________________。
21.(10分)CO不仅是家用煤气的主要成分,也是重要的化工原料。美国近年来报导一种低温低压催化工艺,把某些简单的有机物经“羰化”反应后可以最后产生一类具有优良性能的装饰性高分子涂料、粘胶剂等,如下图所示:

电石
酒精
图中G(RCOOR’)有一种同分异构体是E的相邻同系物;而H有一种同分异构体则是F的相邻同系物。已知D由CO和H2按物质的量之比为1:2完全反应而成,其氧化产物可发生银镜反应;H是含有4个碳原子的化合物。
试推断:
(1)写出B、E、G的结构简式
B: E: G:
写出与G同类别的两个G的同分异构体的结构简式
(2)完成下列反应的化学方程式
①A+CO+H2O
②F+D
③G 高分子化合物
高分子化合物
20.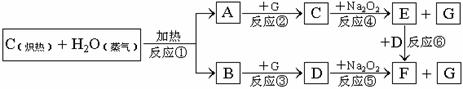 (12分)根据下面物质间转换的框图,回答有关问题:
(12分)根据下面物质间转换的框图,回答有关问题:
(1)由反应①产生的A、B混合物的工业名称是 。
(2)写出框图中D、E的电子式:D ;E
(3)2mol Na2O2与足量水蒸气反应,可得标准状况下气体的体积是 L,同时反应中转移电子总数是 。(NA表示阿佛加德罗常数)
(4)请设计一个课堂小实验,证实反应⑤是放热反应。
(5)如果A、B混合气体7.8g(平均摩尔质量10g·mol-1),在与G充分反应后,通过足量Na2O2层,可使Na2O2增重 g,并得到O2 mol。
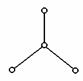
19. (8分) 2000年美国《科学》杂志报道,意大利科学家合成了一种新型氧分子,它是由4个氧原子构成的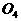 分子,专家认为它液化后的能量密度比普通氧分子高得多。
分子,专家认为它液化后的能量密度比普通氧分子高得多。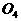 分子的结构如下图所示,是平面型分子,键角为120°。四个氧原子以一个O原子为中心,与另外三个O原子分别构成一个非极性共价键;中间O原子提供三个电子,周围三个O原子各提供1个电子,构成一个特殊的化学键--四个O原子均等地享有这6个电子,请回答:
分子的结构如下图所示,是平面型分子,键角为120°。四个氧原子以一个O原子为中心,与另外三个O原子分别构成一个非极性共价键;中间O原子提供三个电子,周围三个O原子各提供1个电子,构成一个特殊的化学键--四个O原子均等地享有这6个电子,请回答:
(1)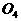 固体属于____________晶体(填“原子”、“离子”、“分子”、“金属”)
固体属于____________晶体(填“原子”、“离子”、“分子”、“金属”)
(2)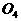 与氧气的关系是___________________,它们之间的转化是否为氧化还原反应_________(填“是”或“否”)。
与氧气的关系是___________________,它们之间的转化是否为氧化还原反应_________(填“是”或“否”)。
(3)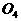 具有强氧化性,能将
具有强氧化性,能将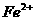 氧化为
氧化为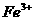 ,试配平:
,试配平:

在该反应中,当生成1 mol 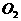 ,转移电子的物质的量为________ mol。
,转移电子的物质的量为________ mol。
18. (10分)下图是化学研究小组设计的铜与稀硝酸反应的两个实验装置图。其中装置Ⅰ为甲同学设计。(注:NaOH溶液可吸收NOx)

请回答下列问题:
(1) 铜与稀硝酸反应的离子方程式为_____________________________________。
(2) 乙同学认为装置Ⅰ中收集的气体不能确定铜与稀硝酸反应生成的是NO气体,理由_________________________________________________。于是他设计了装置Ⅱ。化学研究小组的其他同学对上述实验进行了研究,认为如果按装置Ⅱ进行实验,与装置Ⅰ相比较可能会出现三个问题,需要作相应改进措施。请你帮助他们填写相关内容。
问题一:_______________________________。
措施:对试管加热或者____________________________。
问题二:试管中的气体是淡棕红色,而不是无色。
措施:_________________________________________________________
___________________________(填具体操作。可增加试剂但不能增加装置)。
问题三:______________________________________________________。
措施:__________________________________________________________。
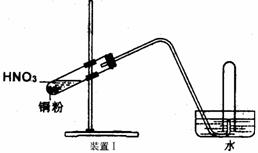
17. (10分)实验室里可用右图的装置制取溴化亚铁。其中,A为CO2发生装置,D和d中均盛有液溴,E为外套电炉丝的不锈管,e是两只耐高温的瓷夹,其中共盛有56g细铁粉。实验开始时先将铁粉加热至600-700℃,然后将干燥、纯净的CO2气流通入D中,E管中的物质开始反应,不断地将d中的液溴滴入100-120℃的D中,经过几小时的连续反应后在不锈钢管一端沉积有黄绿色鳞片状溴化亚铁80g。
(10分)实验室里可用右图的装置制取溴化亚铁。其中,A为CO2发生装置,D和d中均盛有液溴,E为外套电炉丝的不锈管,e是两只耐高温的瓷夹,其中共盛有56g细铁粉。实验开始时先将铁粉加热至600-700℃,然后将干燥、纯净的CO2气流通入D中,E管中的物质开始反应,不断地将d中的液溴滴入100-120℃的D中,经过几小时的连续反应后在不锈钢管一端沉积有黄绿色鳞片状溴化亚铁80g。
(1)如何检查D装置的气密性?__________________________________________
_______________________________________________________________。
(2)若导入的CO2不干燥,会在E中发生副反应,其化学方程式为_____________________________________ 。
(3)在A中盛有CaCO3,a中盛有6mol·L-1盐酸。为使A中产生的CO2在进入D之前既干燥又纯净,B、C处应设置和各仪器中应盛有何种试剂?
。
(4)实验时,D和E的橡胶塞为什么最好用铝箔包住?_______________________。
(5)反应过程中不断地通入CO2,其主要作用是:① ,② 。
(6)E中进行的反应是:2Fe+3Br2=2FeBr3,2FeBr3=2FeBr2+Br2↑。此实验中溴化亚铁的产率为 。
(7)为防止污染空气,实验时应在F处连接盛有 的尾气吸收装置。
16.(8分)
(1)举两例说明实验室应注意的安全问题或处理措施:_____________________________________________________________________
____________________________________________________________________。
(2)在中和热的测定实验中,取50 mL 0.50 mol·L-1的盐酸,一般加入50 mL 0.55 mol·L-1 NaOH溶液。
①不用50 mL 0.50 mol·L-1 NaOH溶液的原因是:_____________________
______________________________________________________;
②若用盐酸和NaOH固体,对实验的影响是测定结果_______________;
(3)在硫酸铜晶体结晶水含量的测定实验中,若坩埚的质量为m,坩埚与硫酸铜晶体的质量为m1,加热后称量坩埚与无水硫酸铜的质量为m2,则晶体中结晶水的质量分数w=_______________(写计算式)。如果实验中加热温度过高,固体颜色变黑,则测定结果会_______________(填“不变”“偏高”或“偏低”)。
15.在一定温度下,把3.0moLM和2.5moLN混合于2.0L的密闭容器中,发生反应的化学方程式为:3M(g)+N(g)  xP(g)+2Q(g) ,5min后反应达到平衡,容器内的压强变小,已知Q的平均反应速率为0.10 mol·L-1·min-1,下列说法错误的是
xP(g)+2Q(g) ,5min后反应达到平衡,容器内的压强变小,已知Q的平均反应速率为0.10 mol·L-1·min-1,下列说法错误的是
A.平衡时容器内的压强是原来的0.8倍
B.M的平均反应速率为0.15 mol·L-1·min-1
C.x的值为1
D.平衡时P的浓度为0.25 mol·L-1
第Ⅱ卷(非选择题 共88分)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com